题目内容
【题目】请你参与下列探究:
(问题情景)在课外活动中,小斌按照课本实验(见下图1)探究分子的运动时,闻到了刺激性的氨味,于是,小斌在老师的指导下,设计了如图2的实验装置,进行同样的实验,结果不再有刺激性的氨味,并且快速出现实验现象,得到了和课本实验同样的结论。

(实验探究与结论)小斌用图2装置进行实验。
(1)滴入少量浓氨水后,湿润的酚酞滤纸条发生的变化是__________________。从分子运动的角度分析,此现象可说明的结论是__________________________。
(2)和课本实验比较,小斌改进后的装置的优点是:(写出2点)_________ _____________。
(思维拓展)小媚受小斌实验的启发,将图2装置进一步改装成图3装置,用于验证二氧化碳的性质:打开活塞K滴入稀硫酸后,两条用紫色石蕊试液润湿的试纸发生的相同变化是______________________不同是___________________________小媚从课本实验中知道,二氧化碳和水本身都不能使石蕊变色,因而她认为以上两个变化验证的二氧化碳的性质依次是______________ 、_______________ 。
【答案】小纸条变红 分子的不断运动的 反应速度快 不污染空气 湿润的石蕊试纸都变成红色 试管下面的试纸比上面的先变红 二氧化碳能与水反应生成碳酸,使石蕊变红 二氧化碳密度比空气大
【解析】
(1)滴入少量浓氨水(显碱性)后,湿润的酚酞滤纸条遇碱性物质变红,则发生的变化是:小纸条变红;从分子运动的角度分析,此现象可说明的结论是:分子是不断运动的;
(2)和课本实验比较,小斌改进后装置的优点是:氢氧化钠溶于水放热,分子运动速率加快,即反应速率快,装置在密闭环境中,不污染空气等;
思维拓展:小媚受小斌实验的启发,将图2装置进一步改装成图3装置,用于验证二氧化碳的性质:打开活塞K滴入稀硫酸(显酸性)后,石蕊试液遇酸性物质变红,则两条用紫色石蕊试液润湿的试纸发生的相同变化是:湿润的石蕊试纸都变成红色;不同的是:试管下面的试纸比上面的先变红,因为二氧化碳的密度比空气大;小媚从课本实验中知道,二氧化碳和水本身都不能使石蕊变色,因而她认为以上两个变化验证的二氧化碳的性质依次是:二氧化碳能与水反应生成碳酸,碳酸使石蕊变红;二氧化碳密度比空气大。

【题目】(探究活动一)为探究催化剂的种类对氯酸钾分解速率的影响,甲同学设计如表对比实验:
氯酸钾的质量 | 催化剂的种类 | 催化剂 的质量 | 反应条件 | 收集45.0mLO2所需的时间(s) | |
Ⅰ | 3.0g | MnO2 | 1.0g | 混合加热 | 21 |
Ⅱ | xg | CuO | 1.0g | 混合加热 | 48 |
(1)表Ⅱ中x的值应为___________;通过分析上表数据,可以得出的实验结论是:在相同的条件下,KClO3在MnO2作催化剂比CuO作催化剂的分解速率_______ (选填“快”或“慢”);写出氯酸钾、二氧化锰加热反应的文字表达式________。
(探究活动二)为探究过氧化氢浓度对过氧化氢分解速率的影响,乙同学设计以下实验:
[进行实验]
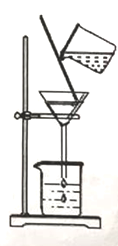
室温下,选用50.0g不同溶质质量分数的过氧化氢溶液(1%、2%和4%)分别与0.1g二氧化锰进行实验(如图1,固定夹持仪器略去)。

(2)MnO2在H2O2分解前后其质量和__________没有发生改变,试写出H2O2分解反应的文字表达式________。
[数据处理]
(3)乙同学进行实验后,获得的相关实验数据记录如表所示:
过氧化氢溶液的质量 | 过氧化氢的浓度 | MnO2的质量 | 温度 | 相同时间(10s)内产生O2体积(mL) | |
Ⅰ | 1% | 0.1g | 20℃ | 9 | |
Ⅱ | 50.0g | 2% | 0.1g | 20℃ | 16 |
Ⅲ | 50.0g | 4% | 0.1g | 20℃ | 31 |
①本实验中,测量O2体积的装置也可以选用如图2的哪套装置来代替_________(填编号)。

②分析上表数据,可以得出不同浓度的过氧化氢对过氧化氢分解速率影响的结论是:_________
【题目】在研究“酸碱中和反应”时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究:
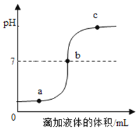
(1)在盛有氢氧化钠溶液的烧杯中滴人几滴酚酞试液,再逐滴加入稀盐酸,并不断搅拌(如图一)。用数字化传感器测得盐酸与氢氧化钠溶液混合前后的温度变化情况(如图二)。
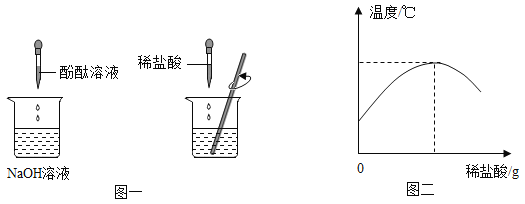
图一实验中滴加稀盐酸后发生的现象为__________________;由实验现象和曲线变化情况分析可知,盐酸和氢氧化钠溶液发生了反应并________(填“吸收”或“放出”)热量。
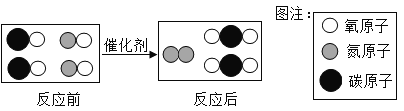
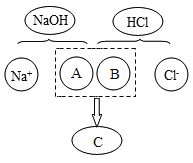
(2)从微观角度分析盐酸与氢氧化钠溶液的反应如图描述了该反应的微观实质,图中A、B、C处应填入的化学符号依次是____________。
(3)同学们讨论后认为,如果用检验盐酸和氢氧化钠减少(或消失)、或者有新物质生成,都能证明反应已经发生。继续探究实验后烧杯中溶质的成分,来证明反应的发生。
步骤 | 现象 | 结论 |
实验1:取烧杯中的溶液少许于试管中,加入硫酸铜溶液 | ____________________________ | 证明没有 |
实验2:另取烧杯中的溶液少许于试管中,加入硝酸银溶液 | 出现白色沉淀 | 证明含有 |
实验3:再取烧杯中的溶液少许于蒸发皿中,加热蒸干 | 有___________产生 | 证明有 |
(得出结论)氢氧化钠溶液和盐酸发生了中和反应。
(评价反思)有同学认为,仅通过实验2得出“溶液中含有![]() ”证据不足,理由是___________________。
”证据不足,理由是___________________。