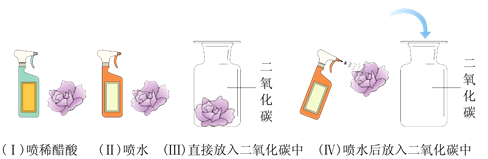
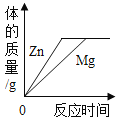
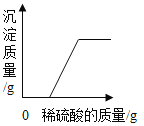
题目内容
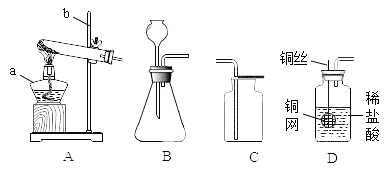
【题目】化学实验是学习化学的重要途径,正确掌握实验基本操作是科学探究的基础。下列实验操作正确的是
A.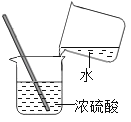 稀释浓硫酸
稀释浓硫酸
B.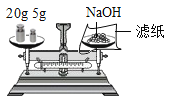 称量固体
称量固体
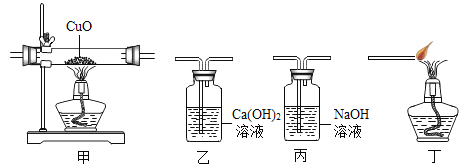
C.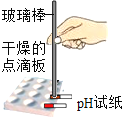 pH的测定
pH的测定
D.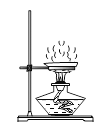 溶液蒸发
溶液蒸发
【答案】C
【解析】
A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中,图中所示操作错误;
B、托盘天平的使用要遵循“左物右码”的原则,且氢氧化钠具有腐蚀性,应放在玻璃器皿中称量,图中所示操作错误;
C、用pH试纸测定未知溶液的pH时,正确的操作方法为取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,图中所示操作正确;
D、蒸发时,应用玻璃棒不断搅拌,以防止局部温度过高,造成液体飞溅,图中所示操作错误。
故选C。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】医用双氧水可杀灭肠道致病菌、化脓性球菌,一般用于物体表面消毒。小明同学腿部擦伤,大夫在她伤口上涂了医用过氧化氢溶液,小明看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
(查阅资料)
(1)过氧化氢是人体代谢废物之一,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(实验探究)
小明准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水,并用排水法。记录2分钟收集的气体体积。
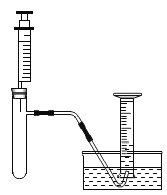
进行实验:
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | (1)__________ |
② | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次向试管中加入一小粒过氧化氢酶,然后浸在37℃的温水中 (2)第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解速率加快是因为过氧化氢酶的作用 |
(3)实验①②中,有三次收集到的气体均为5 mL,若用带火星的木条去检验这5 mL气体,观察到现象是________________。
(4)写出过氧化氢在过氧化氢酶的作用下分解的化学方程式:__________________。
(实验反思)
小明反思了实验过程,认为实验①得出的结论可能存在不足。于是他又查阅资料。科研工作者以10 mL30%的H2O2溶液为样本,加入相同的过氧化氢酶,分别做了如下9组不同的实验,所得如下数据:
序号 | 因素 | O2(ml) | ||
温度 | pH | 浸取时间 | ||
1 | 35 | 6.4 | 6 | 43.7 |
2 | 35 | 6.8 | 8 | 71.6 |
3 | 35 | 7.2 | 10 | 38.4 |
4 | 37 | 6.4 | 6 | 52.3 |
5 | 37 | 6.8 | 8 | 97.6 |
6 | 37 | 7.2 | 10 | 41.2 |
7 | 39 | 6.4 | 6 | 47.4 |
8 | 39 | 6.8 | 8 | 77.4 |
9 | 39 | 7.2 | 10 | 37.7 |
(5)综合分析表中数据,本实验最适宜条件为____组(填序号),影响过氧化氢酶发挥作用的因素有_________。酶对双氧水分解的催化作用受多个因素影响,不仅各个因素独立作用,而且因素之间有联合作用,有时个别因素对酶的抑制较强。
【题目】硝酸(HNO3)是实验室常见的一种酸。实验小组对硝酸的某些性质进行研究。
Ⅰ、挥发性
(实验1)取一瓶质量分数为68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到_____,原因是_____。
Ⅱ、不稳定性
(查阅资料1)硝酸是无色液体,见光或受热分解生成红棕色的NO2气体、氧气及一种无色液体
(1)硝酸分解的化学方程式为:_____。
(实验2)取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26℃)。记录溶液上方的气体颜色随时间的变化情况。
实验编号 | ① | ② | ③ |
实验条件 |
|
|
|
实验现象 | 6分钟出现浅红棕色 15分钟红棕色比较明显 30分钟红棕色非常明显 | 60分钟无明显变化 | 3分钟出现浅红棕色 6分钟红棕色比较明显 10分钟红棕色非常明显 |
(2)实验①、②对比是研究_____对浓硝酸稳定性的影响。
(3)实验①、③对比可得出的结论是_____。
Ⅲ、酸性
(查阅资料2)硝酸能够与金属氧化物反应生成盐和水。
(实验3)向氧化铜粉末中加入硝酸,能够看到的现象是_____。
IV、氧化性
(查阅资料3)浓硝酸在加热条件下能与木炭发生反应:
C+4HNO3(浓)![]() 4NO2↑+CO2↑+2H2O。
4NO2↑+CO2↑+2H2O。
(实验4)如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能是_____。