题目内容
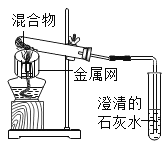
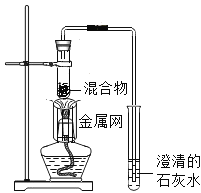
【题目】铜元素有多种氧化物,如![]() .称取14.4g仅含Cu、O两种元素的固体样品、采用如下装置实验(夹持装置省略)。测得实验前后装置B增重4.4g。下列说法正确的是( )
.称取14.4g仅含Cu、O两种元素的固体样品、采用如下装置实验(夹持装置省略)。测得实验前后装置B增重4.4g。下列说法正确的是( )
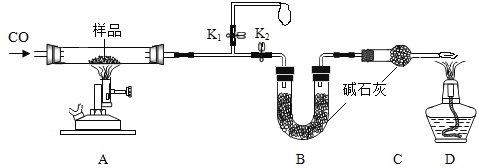
A. 装置B的作用是吸收反应生成的![]() 和
和![]()
B. 实验开始前应先关闭![]() ,打开
,打开![]() ,让CO通一段时间
,让CO通一段时间
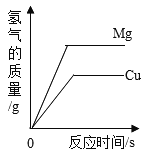
C. 根据实验数据进行计算,可以确定该固体为的组成或有三种可能
D. 若缺少装置C,则实验所得Cu、O个数比偏高
【答案】BC
【解析】
A.该反应中没有氢元素,故反应没有生成水,故A错误;
B.由于一氧化碳是具有可燃性的气体,实验开始前应先关闭K2,打开K1,让CO通一段时间,排除玻璃管中空气,防止加热时发生爆炸,故B正确;
C. 实验前后装置B增重4.4g,即生成二氧化碳4.4g,设铜的化合物中氧元素的质量为x,根据元素守恒,列比例式

![]() ,x=1.6g
,x=1.6g
故铜原子和氧原子的个数比为![]()
则固体组成为①Cu2O,②Cu、CuO③Cu2O、Cu、CuO三种可能,故C正确;
D. 若缺少装置C,则实验测得二氧化碳的质量偏大,计算得到的氧元素质量偏大,所得Cu、O个数比偏低,故D错误。故选BC。

【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(![]() )为黑色固体。
)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:![]() .
.
(进行实验)
实验l:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1-1 | 1-2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1-2装置进行实验。
序号 | 本炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2-1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2-2 | 1:10 | 混有很少量黑色物质 | |
2-3 | 1:11 | 混有极少量黑色物质 | |
2-4 | 1:12 | 无黑色物质 | |
2-5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)实验1-2中,证明![]() 生成的方程式是_____。
生成的方程式是_____。
(2)实验1的目的是_____。
(3)实验2的结论是_____。
(反思与评价)
(4)实验2没有进行质量比为1:14的实验,理由是_____。
(5)为检验2-4的红色固体中是否含![]() ,所需试剂是_____。
,所需试剂是_____。