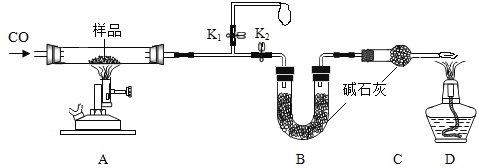
题目内容
【题目】(1)已知:水的密度为1.0g/mL。实验室能制50g溶质质量分数为5%的氯化钠溶液,需要量取水的体积______ ![]() 。
。
(2)配制的操作示意图如下,该实验的正确操作顺序为______(填字母序号)。

(3)经检测,所配制溶液的溶质质量分数偏小,其原因可能是______(填序号)。
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,先用蒸馏水清洗细口瓶
(4)将![]() 与水混合溶解。装瓶贴标签放置,若装瓶过程中有溶液外溅,不会影响所配制溶液的溶质质量分数,原因是______。
与水混合溶解。装瓶贴标签放置,若装瓶过程中有溶液外溅,不会影响所配制溶液的溶质质量分数,原因是______。
【答案】47.5 CBDEA ①②③④ 溶液具有均一性
【解析】
根据溶液的特征和一定溶质质量分数的溶液配制的方法进行分析。
(1)已知:水的密度为1.0g/mL。实验室能制50g溶质质量分数为5%的氯化钠溶液,需要量取水的体积50g-50g×5%=47.5g,47.5g÷1.0g/mL=47.5 mL。
(2)配制的操作示意图如下,该实验的正确操作顺序为CBDEA。
(3)①氯化钠固体不纯和②称量时砝码端忘记垫质量相同的纸片,溶质质量偏小;
③量取水时,仰视读数和④装瓶时先用蒸馏水清洗细口瓶,溶剂质量偏大,所以所配制溶液的溶质质量分数偏小的是①②③④。
(4)装瓶贴标签放置,若装瓶过程中有溶液外溅,不会影响所配制溶液的溶质质量分数,原因是:溶液具有均一性。

【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如下表所示:
物 质 | A | B | C | D |
反应前质量/g | 19.7 | 8.7 | 21.6 | 0.4 |
反应后质量/g | 待测 | 17.4 | 0 | 3.5 |
下列说法正确的是
A.反应后密闭容器中A的质量为19.7g
B.物质C一定是化合物,该反应可能是复分解反应也可能是置换反应
C.反应过程中,物质B和物质D变化的质量比为87∶35
D.若A与C的相对分子质量之比为196∶216,则反应中A和C的化学计量数之比为1∶2
【题目】化工厂用废硫酸制备K2SO4的流程如下:
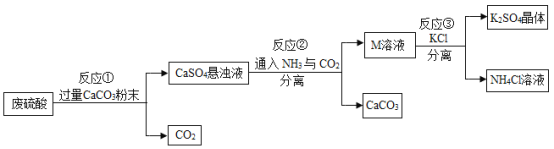
(1)生产上将CaCO3研成粉末的目的是_______欲达此目的,还可采用的方法是__________ (任写一条)
(2)上述流程中,还可循环使用的物质是___(填写化学式).
(3)写出反应①中主要的化学方程式_______
(4)反应③中相关物质的溶解度如下表所示,反应③在常温下可实现的原因是______
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(5)洗涤反应③所得晶体最适宜的试剂是___________ (填序号)
A H2O B 饱和K2SO4溶液 C 二者均可
(6)检验K2SO4晶体是否洗涤干净的方法是 ____________