题目内容
整理和归纳、探究是有效的学习方法.下面是恭城县民族中学化学学习小组的同学对Mg、Al、Fe、Mn、Cu、Hg、Ag五种金属相关知识的归纳复习,请你参与并回答问题:(1)从物理性质上看,每种金属都有自己的特性.你认为汞与其它金属的不同之处是______.
(2)性质决定用途,用途反映性质是重要的化学学科思想.用镁粉制作的烟花在夜空中发出耀眼的白光,这是利用了镁的______性.
(3)铝的化学性质比铁要活泼,但是铝制品却很耐腐蚀,其原因是______.
(4)该化学兴趣小组的同学为了探究铁(Fe)、锰(Mn)和铜(Cu)三种金属的活动性顺序,进行下列探究.
①同学们将等大小的三种金属同时放入等质量、等质量分数的稀硫酸中,发现锰表面冒出气泡的速率比铁快,而铜表面无现象.请将三种金属的元素符号填入下表:

如果金属锰与稀硫酸反应生成的盐是硫酸锰(MnSO4),请你写出锰与稀硫酸反应的化学方程式______.
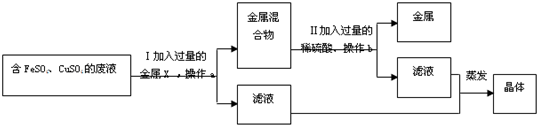
②兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液.他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:

①甲同学提出X可用金属铁,乙同学认为X可用金属锰,你认为______(选填“甲”或“乙”)同学的意见是正确的,理由是______.加入过量的金属X的目的是______.
②操作a、b的名称是______,其目的是除去溶液中______的杂质.步骤Ⅱ中发生反应的化学方程式为______.
【答案】分析:(1)依据金属的物理性质可知常温下汞和大多数金属的状态不同;
(2)镁粉制作的烟花在夜空中发出耀眼的白光,是镁的燃烧过程;
(3)铝易与氧气反应生成氧化铝的保护膜;
(4)题目对金属锰铁铜的金属活动性的探究是通过与相同的硫酸反应来实现的,在实验中要先区分是否反应,之后对能够反应的注意反应速率的对比,最后获得结论.而之后对于硫酸亚铁和硫酸铜溶液回收铜和硫酸亚铁,很容易受到上面锰铁铜实验的干扰,很容易认为锰可以用于该实验.这时就要考虑我们的实验目的,是要除去硫酸亚铁中硫酸铜杂质,在除杂时要注意“除去杂质,不引入新的杂质”的原则.
解答:解:(1)金属汞常温下为液体而大多数金属为固体.
故答案为:常温下Hg是液体而其余均为固体.
(2)镁粉制作的烟花在夜空中发出耀眼的白光,是镁的燃烧发出白光,是镁的可燃性的体现.
故答案为:可燃
(3)铝易与氧气反应生成氧化铝的保护膜,从而阻止铝继续被腐蚀.
故答案为:铝易与氧气反应生成氧化铝的保护膜
(4)①金属锰铁铜金属活动的顺序的探究,题目给予的实验方案是分别加入到相同质量和质量分数的硫酸溶液中,并且告诉实验现象时锰产生气泡的速度比铁快,说明两者都比H活泼,且由于锰反应更快,所以锰比铁更活泼.而铜不反应,证明H>Cu.三种金属和氢元素之间的位置关系就是:Mn>Fe>H>Cu.因此可利用信息书写
有关的化学方程式;
②要想从硫酸亚铁和硫酸铜的废液回收铜和硫酸亚铁晶体,首先要将硫酸铜除去,这就是要先除杂.而除杂的基本原则就是除去杂质,而不能引入的新的杂质.所以在将硫酸铜转化为铜的而过程中加入的药品一定要和硫酸亚铁有关,也就是要使用铁单质来实现该转化.很多同学容易受到上面金属活动探究的影响,认为锰也能够将硫酸铜转化为铜.但是不可以用来除去杂质硫酸铜,因为引入了MnSO4杂质.同时为了将杂质尽可能完全除去,我们加入的药品就要适当过量,所以在除杂时一般不加入状态和要除去杂质状态相同的药品,即液体中加固体或者气体,气体中加固体或者液体.(另外注意加入的铁一般不用铁条或者铁片,而是用铁粉,防止反应在固体表面发生后铜在表面附着,阻碍了反应的进行,从而导致最终铜粉内含有铁固体,且很难用酸类反应掉),在实验过程中ab的操作都是分离固体与液体,因此一般采用过滤的方法进行.
故答案:
①
Mn+H2SO4=MnSO4+H2↑
(2)①甲;可得到纯净的FeSO4晶体;使废液中的铜全部被置换出来;
②过滤;不溶性;Fe+H2SO4=FeSO4+H2↑;
点评:在做题过程中,有时前后之间有牵连,有时是没有关系的,所以在解题时就要分析清楚,避免干扰,从而利用相关的知识进行解题.
(2)镁粉制作的烟花在夜空中发出耀眼的白光,是镁的燃烧过程;
(3)铝易与氧气反应生成氧化铝的保护膜;
(4)题目对金属锰铁铜的金属活动性的探究是通过与相同的硫酸反应来实现的,在实验中要先区分是否反应,之后对能够反应的注意反应速率的对比,最后获得结论.而之后对于硫酸亚铁和硫酸铜溶液回收铜和硫酸亚铁,很容易受到上面锰铁铜实验的干扰,很容易认为锰可以用于该实验.这时就要考虑我们的实验目的,是要除去硫酸亚铁中硫酸铜杂质,在除杂时要注意“除去杂质,不引入新的杂质”的原则.
解答:解:(1)金属汞常温下为液体而大多数金属为固体.
故答案为:常温下Hg是液体而其余均为固体.
(2)镁粉制作的烟花在夜空中发出耀眼的白光,是镁的燃烧发出白光,是镁的可燃性的体现.
故答案为:可燃
(3)铝易与氧气反应生成氧化铝的保护膜,从而阻止铝继续被腐蚀.
故答案为:铝易与氧气反应生成氧化铝的保护膜
(4)①金属锰铁铜金属活动的顺序的探究,题目给予的实验方案是分别加入到相同质量和质量分数的硫酸溶液中,并且告诉实验现象时锰产生气泡的速度比铁快,说明两者都比H活泼,且由于锰反应更快,所以锰比铁更活泼.而铜不反应,证明H>Cu.三种金属和氢元素之间的位置关系就是:Mn>Fe>H>Cu.因此可利用信息书写
有关的化学方程式;
②要想从硫酸亚铁和硫酸铜的废液回收铜和硫酸亚铁晶体,首先要将硫酸铜除去,这就是要先除杂.而除杂的基本原则就是除去杂质,而不能引入的新的杂质.所以在将硫酸铜转化为铜的而过程中加入的药品一定要和硫酸亚铁有关,也就是要使用铁单质来实现该转化.很多同学容易受到上面金属活动探究的影响,认为锰也能够将硫酸铜转化为铜.但是不可以用来除去杂质硫酸铜,因为引入了MnSO4杂质.同时为了将杂质尽可能完全除去,我们加入的药品就要适当过量,所以在除杂时一般不加入状态和要除去杂质状态相同的药品,即液体中加固体或者气体,气体中加固体或者液体.(另外注意加入的铁一般不用铁条或者铁片,而是用铁粉,防止反应在固体表面发生后铜在表面附着,阻碍了反应的进行,从而导致最终铜粉内含有铁固体,且很难用酸类反应掉),在实验过程中ab的操作都是分离固体与液体,因此一般采用过滤的方法进行.
故答案:
①

Mn+H2SO4=MnSO4+H2↑
(2)①甲;可得到纯净的FeSO4晶体;使废液中的铜全部被置换出来;
②过滤;不溶性;Fe+H2SO4=FeSO4+H2↑;
点评:在做题过程中,有时前后之间有牵连,有时是没有关系的,所以在解题时就要分析清楚,避免干扰,从而利用相关的知识进行解题.

练习册系列答案
相关题目
 某学习小组的同学对物质燃烧知识进行了整理和探究.请你一起参与!
某学习小组的同学对物质燃烧知识进行了整理和探究.请你一起参与!
(1)木炭燃烧实验:
①木炭在氧气中燃烧的现象是________,完全燃烧的反应文字表达式是________.
②检验如图集气瓶中木炭燃烧产物的方法是________.
(2)对燃烧是否产生火焰的探究:
发现问题:木炭在空气和氧气中燃烧均不产生火焰,而氢气、
蜡烛、酒精等在空气或氧气中燃烧都产生火焰.那么,物质燃烧是否产生火焰与什么因素有关呢?
提出假设:a.与氧气的浓度有关b.与可燃物的状态有关c.与燃烧达到的温度和可燃物沸点的相对大小有关
整理资料:小组同学查阅资料并归纳整理如下表:
| 物质名称 | 物质状态 | 沸点(℃) | 燃烧达到的温度(℃) | 是否产生火焰 |
| 氢气 | 气 | -259 | 约2750 | 是 |
| 一氧化碳 | 气 | 约-190 | 约2500 | 是 |
| 木炭 | 固 | 约4827 | 约1200 | 否 |
| 石蜡 | 固 | 约300 | 约600 | 是 |
| 钠 | 固 | 约883 | 约1400 | 是 |
| 铁 | 固 | 约2750 | 约1800 | 否 |
②分析表中数据,可以得出有关假设b的结论是:物质燃烧是否产生火焰与可燃物的状态________必然的联系(填“有”、“没有”);
③分析表中数据,可以得出有关假设c的结论是可燃物燃烧所能达到的温度________可燃物沸点(填“高于”、“等于”或“低于”)时产生火焰,反之则否.


 某学习小组的同学对物质燃烧知识进行了整理和探究.请你一起参与!
某学习小组的同学对物质燃烧知识进行了整理和探究.请你一起参与!