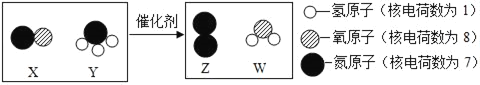
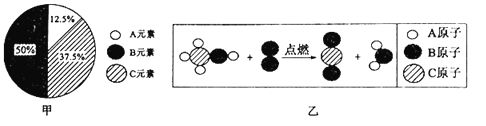
题目内容
【题目】(1)某同学将CO2缓慢通入NaOH溶液,通入一段时间后,溶液中溶质的成分有4种可能情况(忽略CO2在水中的溶解),请将四种情况中溶质的化学式填入如表。
编号 | ① | ② | ③ | ④ |
溶质 | _____ | _____ | _____ | _____ |
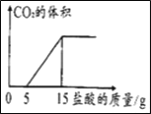
(2)已知:向Na2CO3溶液中滴入稀盐酸时,先发生反应①Na2CO3+HCl=NaHCO3+NaCl,当Na2CO3反应完全后,继续滴入稀盐酸,发生反应②NaHCO3+HCl=NaCl+H2O+CO2↑.该同学向第(1)题所得溶液中逐滴加入含HCl质量分数为3.65%的盐酸,所加入盐酸的质量与产生CO2气体的体积(标准状况下)的关系如图所示。则该同学在NaOH溶液中通入CO2后,溶液中溶质的化学式和质量分别为_____;_____。
【答案】NaOH、Na2CO3 Na2CO3 Na2CO3、NaHCO3 NaHCO3 NaHCO3 Na2CO3.,m(Na2CO3)=0.53g. ;NaHCO3 , m(NaHCO3)=0.42g
【解析】
(1)某同学将CO2缓慢通入NaOH溶液,通入一段时间后:
①n(NaOH):n(CO2)>2:1,少量二氧化碳和氢氧化钠反应:2NaOH+CO2═Na2CO3+H2O,剩余NaOH,溶质为:Na2CO3、NaOH;
②再通入二氧化碳,n(NaOH):n(CO2)=2:1,氢氧化钠全部转化为碳酸钠,溶质为:Na2CO3;
③继续通入二氧化碳,1:1<n(NaOH):n(CO2)<2:1,Na2CO3+H2O+CO2═2NaHCO3,有部分碳酸钠,溶质为:Na2CO3、NaHCO3;
④继续通入二氧化碳,n(NaOH):n(CO2)=1:1,碳酸钠全部转化为碳酸氢钠,溶质为:NaHCO3;n(NaOH):n(CO2)<1:1,二氧化碳剩余,溶质为:NaHCO3;
(2)据图可知:刚开始没有生成气体,说明向Na2CO3溶液中滴入稀盐酸时,先发生反应①Na2CO3+HCl=NaHCO3+NaCl,当Na2CO3反应完全后,继续滴入稀盐酸,发生反应②NaHCO3+HCl= NaCl+H2O+CO2↑,溶液中溶质的化学式为:Na2CO3、NaHCO3;
设参加反应Na2CO3的质量为x,同时生成NaHCO3的质量为y,
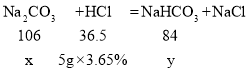
![]() x=0.53g,
x=0.53g,
![]() y=0.42g,
y=0.42g,
设参加反应NaHCO3的总质量为z,
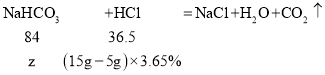
![]()
z=0.84g,
该同学在NaOH溶液中通入CO2后,溶液中NaHCO3的质量=0.84g-0.42g=0.42g;Na2CO3的质量为0.53g。

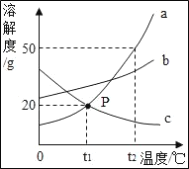
【题目】KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是( )
温度/℃ | 20 | 30 | 40 | 50 | |
溶解度S/g | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
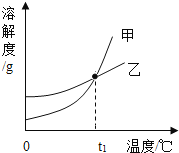
A. 甲表示KNO3溶解度曲线
B. 温度t1℃应在20~30℃之间
C. 40℃时,10gKC1加入20g水中,可得到33.3%的溶液
D. 50℃时,30gKNO3加入50g水,充分溶解,再降温到30℃,有晶体析出