题目内容
【题目】实验室中有一包由KC1、MgSO4和CaCl2组成的固体混合物,某校研究性学习小组的同学为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计了如图实验方案。请你回答 下列问题:
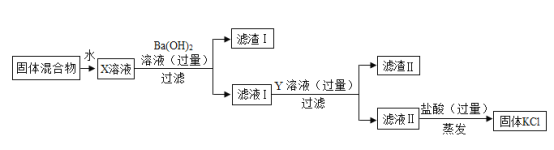
(1) X溶液与Ba (OH) 2溶液反应的化学方程式是_____。
(2) Y溶液中溶质的化学式是_____;Y溶液与Ba(OH)2溶液调换顺序,会造成KCl固体中混有_____(写化学式);蒸发时玻璃棒的作用是_____。
(3)写出实验中与盐酸发生中和反应的化学方程式_____。
【答案】MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓ K2CO3 BaCl2 搅拌作用,防止局部温度过高,造成液滴飞溅 KOH+HCl=KCl+H2O
【解析】
由KCl、MgSO4,和CaCl2组成的固体混合物,加水溶解,然后加过量的氢氧化钡溶液,硫酸镁和氢氧化钡反应生成硫酸钡和氢氧化镁白色沉淀,过滤后,向滤液Ⅰ中加入过量的碳酸钾溶液,氯化钙和碳酸钾反应生成碳酸钙白色沉淀和氯化钾,氢氧化钡和碳酸钾反应生成碳酸钡白色沉淀和氢氧化钾,过滤后,向滤液Ⅱ加盐酸,蒸发即可得到固体氯化钾。
(1)硫酸镁和氢氧化钡反应生成硫酸钡和氢氧化镁白色沉淀,化学反应方程式MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓;
(2)Y溶液是碳酸钾溶液,溶质是碳酸钾,化学式为:K2CO3;Y溶液与Ba(OH)2溶液调换顺序:由KCl、MgSO4,和CaCl2组成的固体混合物,加水溶解,然后加过量的碳酸钾,氯化钙和碳酸钾反应生成碳酸钙白色沉淀和氯化钾;过滤后,滤液中含有的溶质为氯化钾、硫酸镁、碳酸钾,向滤液中加入过量的氢氧化钡溶液,硫酸镁和氢氧化钡反应生成硫酸钡和氢氧化镁白色沉淀,氢氧化钡和碳酸钾反应生成碳酸钡白色沉淀和氢氧化钾,过滤后,向滤液中有氢氧化钡、氢氧化钾和氯化钾,再加盐酸,蒸发会得到固体氯化钾和氯化钡。蒸发过程中玻璃棒的作用是:搅拌作用,防止局部温度过高,造成液滴飞溅。
(3)实验中氢氧化钾与盐酸发生中和反应,化学方程式KOH+HCl=KCl+H2O。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案