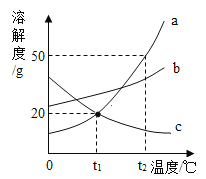
题目内容
【题目】下列关于2CO+O2![]() 2CO2的说法不正确的是( )
2CO2的说法不正确的是( )
A.表示一氧化碳与氧气在点燃条件下反应生成二氧化碳
B.参加反应的一氧化碳与氧气的质量比为7:8
C.反应前后碳原子、氧原子的个数均保持不变
D.参加反应的一氧化碳与生成的二氧化碳的分子个数比为1:1
【答案】B
【解析】
A、该反应可表示一氧化碳与氧气在点燃条件下反应生成二氧化碳,故选项说法正确;
B、参加反应的一氧化碳与氧气的质量比为(28×2):32=7:4,故选项说法错误;
C、化学反应前后碳原子、氧原子的个数均保持不变,故选项说法正确;
D、微观上,点燃条件下,每2个一氧化碳分子和1个氧分子反应生成2个二氧化碳分子,则参加反应的一氧化碳与生成的二氧化碳的分子个数比为2:2=1:1,故选项说法正确。
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为探究某塑料的元素组成,某实验小组设计了实验I和Ⅱ。回答下列问题:
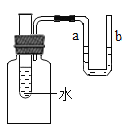
I.制取氧气
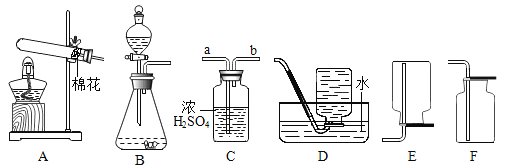
(1)A中用于加热的仪器名称是_______________;若用一种暗紫色固体制取干燥的O2,发生反应的化学方程式为____________,选择的装置组合为__________ (填字母)。
Ⅱ.组成探究
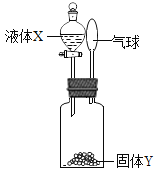
(2)定性检测(已知:无水CuSO4遇水变蓝色)
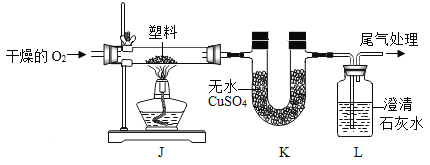
实验操作 | 实验现象 | 结论 |
连接装置,检查气密性,装入试剂并按上图进行实验。通入干燥的O2,一段时间后,点燃J处酒精灯 | ①装置K中无水CuSO4变__色 | 塑料燃烧产物中有H2O |
②装置L中__________ | 塑料燃烧产物中有CO2 |
③由上述实验可知,该塑料一定含有的元素是___________(填元素符号)。
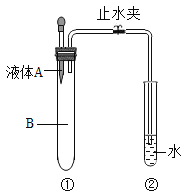
【题目】同学们在做铝与硫酸铜溶液反应的实验时,有的组铜较快析出形成铜树,有的组却较慢。课后,化学小组同学对影响铝与硫酸铜溶液反应速率的因素进行了如下探究。
![]()
(进行实验)如图所示进行实验。小组同学做了实验1和实验2两组实验,实验记录如下表。每次实验中所用铝条长度、粗细相同,伸入到硫酸铜溶液部分绕成的螺旋数相同;硫酸铜溶液的体积相同。
实验1:
编号 | 温度/℃ | 硫酸铜溶液的 溶质质量分数 | 铝条 是否打磨 | 实验现象 |
1-1 | 20℃ | 8% | 打磨 | 生成红色铜树的速度较慢 |
1-2 | 30℃ | 8% | 打磨 | 生成红色铜树的速度较快 |
1-3 | 40℃ | 8% | 打磨 | 生成红色铜树的速度快 |
实验2:
编号 | 温度/℃ | 硫酸铜溶液的 溶质质量分数 | 铝条 是否打磨 | 实验现象 |
2-1 | 20℃ | 16% | 打磨 | 生成红色铜树的速度较快 |
2-2 | 20 | 16% | 未打磨 | 生成红色铜树的速度较慢 |
(解释与结论)
(1)铝与硫酸铜溶液反应的化学方程式为_____。
(2)通过实验1可得到的结论是_____。
(3)通过对比实验_____(填编号),可得到“硫酸铜溶液的溶质质量分数是影响铝与硫酸铜溶液反应速率的因素之一”。
(4)实验2的目的是_____。
(反思与评价)
(5)在做铝与酸反应、铝与盐溶液反应的实验前,要打磨铝条,其目的是除去铝表面的_____(填化学式)。
(6)影响铝与硫酸铜溶液反应速率的因素还可能有_____(写出1条即可)。
【题目】某矿样含有大量的 CuS 及少量其它不溶于水、不与酸反应的杂质。实验室中 以该矿样为原料制备CuSO4·5H2O晶体,并最终制取碱式碳酸铜。
I. 制备CuSO4·5H2O晶体
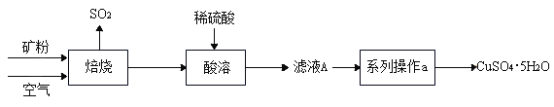
(1)矿样中 CuS 在空气中焙烧生成了 CuO,反应方程式为___;
(2)在实验室中,欲用 98%、密度1.84g/cm3的浓硫酸配制500 g质量分数10%的稀硫酸, 需要的仪器除量筒、烧杯、玻璃棒外,还有___。稀释过程___(填“放热”或“吸 热”)。
(3)若在实验室中完成系列操作 a,主要步骤为____→降温结晶→____→洗涤→低温干燥。(以上选填字母)
II. 制备碱式碳酸铜
(4)实验室制备碱式碳酸铜的反应原理为:(将短线上的物质补充完整)
![]() ____↑+2Na2SO4。
____↑+2Na2SO4。
(5)分别取 50mL一定浓度的CuSO4溶液与Na2CO3 溶液混合,发现反应后烧杯底部出现大量蓝绿色沉淀。查阅资料得知蓝绿色沉淀中混有难溶于水的碱式硫酸铜[Cu2(OH)2SO4]。为确定该物质,经过滤、洗净后取少量固体于试管中,加入足量稀盐酸将固体完全溶解,再滴加几滴____溶液出现白色沉淀,证明含有Cu2(OH)2SO4。
(6)按最佳配比进行实验制备碱式碳酸铜,反应过程中测得数据如下:
温度/℃ | 60 | 65 | 75 | 80 | 90 |
沉淀量/g | 1.295 | 1.303 | 1.451 | 1.340 | 1.292 |
据此分析制备反应控制的适宜温度是____,推测 90°C固体较少的原因是____。
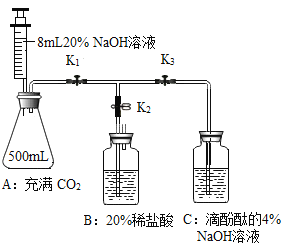
(7)查阅资料可知碱式碳酸铜的组成有多种,可用xCu(OH)2yCuCO3表示。某小组利用 以下装置测定某碱式碳酸铜样品的组成:(资料:碱式碳酸铜受热分解成三种常见的氧化物;碱石灰是氧化钙与氢氧化钠的混合物)
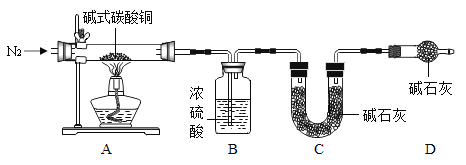
①加热时持续通入N2的目的是____,D 装置的作用是____。
②称取 32.0g 样品,充分反应后得到 24.0g 残留物,B 增重 3.6g,C 增重 4.4g。该样品的化学式为____。若对调 B 和 C 装置的位置,____(填“能”或“不能”)测算出该样品的化学式。