题目内容
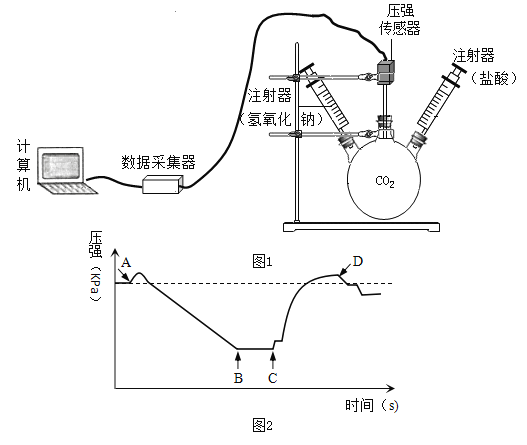
【题目】向20.0mL质量分数为3%的盐酸中滴加氢氧化钠溶液,溶液中的pH随所加氢氧化钠溶液的体积变化如图所示。叙述错误的是( )
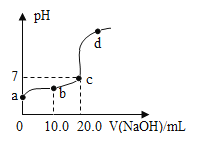
A.所用氢氧化钠溶液的质量分数为3%
B.a、b点对应溶液的pH:a<b
C.c点时溶液温度最高
D.c、d点对应的氯化钠质量:c=d
【答案】A
【解析】
A、由化学方程式NaOH+HCl=NaCl+H2O可知,参加反应的氢氧化钠与盐酸的质量比=40:36.5,即氢氧化钠与盐酸恰好完全反应时消耗的氢氧化钠的质量要多一点,虽然二者恰好完全反应时所用溶液的体积相同,但题目中没有指明两种溶液的密度,所以无法确定所用氢氧化钠溶液的溶质质量分数,选项错误;
B、随着滴入的氢氧化钠与盐酸的反应,溶液中的盐酸越来越少,溶液的酸性逐渐减弱,则溶液的pH越来越大,所以a、b点对应溶液的pH的关系为a<b,选项正确;
C、酸与碱发生的中和反应是一个放热的反应,由图可知,c点时氢氧化钠与盐酸恰好完全反应,此时放出的热量最多,所以溶液的温度最高,选项正确;
D、c点时氢氧化钠与盐酸恰好完全反应生成氯化钠和水,继续加入氢氧化钠溶液反应不再发生,氯化钠的质量不再增加,所以c、d点对应的氯化钠质量:c=d,选项正确,故选A。

【题目】阅读下面科普短文。
目前市场上鸡蛋的价格悬殊,那么鸡蛋到底是不是越贵越好呢?价格偏高的柴鸡蛋和普通鸡蛋,到底哪个营养成分更高呢?
表1不同鸡蛋中主要营养物质的平均含量(每100g)
蛋白质/g | 脂肪/g | 维生素A/ug | 维生素B2/mg | 钙/mg | 铁/mg | |
柴鸡蛋 | 14.4 | 6.4 | 199 | 0.12 | 76 | 1.7 |
普通鸡蛋 | 13.3 | 8.8 | 234 | 0.11 | 56 | 2.4 |
蛋壳上的气孔是鸡蛋呼吸和内外物质交换的主要通道,蛋内水分和CO2通过气孔向外逸出,鸡蛋质量减轻,图1为普通鸡蛋不同存储条件下的失重情况。
水煮蛋由于其加工温度相对较低,不仅营养成分保持较好,而且蛋白质的消化吸收率也很高。在煮鸡蛋加工过程中煮制时间与食用品质的关系如图2。
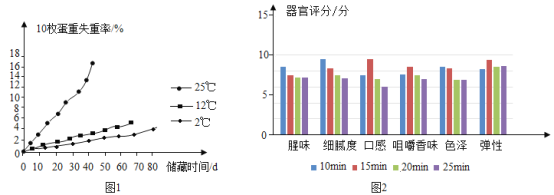
依据文章内容回答下列问题。
(1)表1中的某种元素人体摄入量过低会引起骨质疏松,该元素是________。
(2)依据图1可知,影响鸡蛋失重率的因素有_________。
(3)由图2可知:口感评分与煮制时间的关系是________。
(4)由图2可知:25min内,_________(填序号,下同)。
A煮制20min比25min腥味、弹性、色泽均无明显变化
B煮制15min,口嚼香味、弹性最佳
C随着煮制时间的增加,细腻度分值降低
(5)结合表1说明:没有必要追求高价鸡蛋原因_______。