题目内容
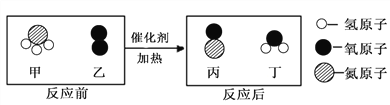
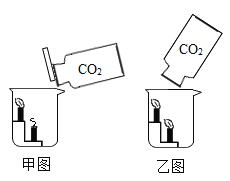
【题目】为探究锌、铜、铁三种金属的活动性顺序及其相关性质,某学习小组做了如甲图所示实验。实验结束后,将试管①、试管②内的物质全部倒入同一洁净烧杯中,充分反应后如乙图所示。将烧杯乙中的物质过滤,得到滤渣和滤液。下列有关说法正确的是
温馨提示:CuO+H2SO4=CuSO4+H2O

A.滤渣中最多有三种物质
B.若滤液呈无色,滤液中的溶质可能有两种
C.若滤液中含有硫酸铜,滤渣中可能有两种物质
D.滤液的质量可能小于甲图中向两试管中加入的FeSO4溶液和稀硫酸的质量之和
【答案】C
【解析】
由于锌的金属活动性比铁强,所以,图甲①中锌与硫酸亚铁反应,置换出铁,图甲②中氧化铜与稀硫酸反应生成硫酸铜和水,将试管①、试管②内的物质全部倒入同一洁净烧杯中,当试管①中有剩余锌,试管②中有硫酸铜,混合后,硫酸铜首先与锌反应,置换出铜,硫酸铜与锌反应完后,剩余硫酸铜才与铁反应,置换铜,据此思路进行解答。
A、当试管①中锌过量,试管②中氧化铜过量,两者混合后,若硫酸铜的量只能与部分锌反应,置换出铜,则此时,滤渣中含有过量的氧化铜,试管①置换出的铁,剩余的锌,置换出的铜四种物质,选项说法错误,故不符合题意;
B、若滤液呈无色,溶液中只有一种溶质硫酸锌, 选项说法错误,故不符合题意;
C、当试管②中氧化铜过量,试管①中锌过量时,将试管①、试管②混合,锌先与试管②的生成物硫酸铜反应,置换出铜,完全反应后,试管①中生成物铁与硫酸铜反应,铁也被完全反应后,滤渣含有中铜和氧化铜,选项说法正确,故符合题意;
D、图甲①中锌与硫酸亚铁反应,置换出铁,每65份质量的锌会置换出56份质量的铁,根据质量守恒定律可得,该反应溶液质量增加,图甲②中氧化铜与稀硫酸反应,固体溶解,无沉淀、气体生成,因此,反应后溶液质量也增加,混合后,若试管②稀硫酸过量,锌、铁与过量稀硫酸反应,反应后的溶液质量也增加,当硫酸铜与锌反应时,反应后溶液质量增加,硫酸铜与铁反应时,反应后溶液质量减小,所以,当锌、铁不与硫酸铜溶液反应只与稀硫酸反应时,反应后滤液的质量一定大于甲图中向两试管中加入的FeSO4溶液和稀硫酸的质量之和,当只有锌和硫酸铜反应时,反应后溶液质量也大,锌、铁都与硫酸铜反应时,由于只有一部分硫酸铜与铁反应,最总导致反应后溶液质量仍然大,选项说法错误,故不符合题意,故选C。

【题目】KNO3和NaCl在不同温度时的溶解度如下图所示,请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线如图所示:
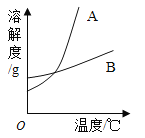
图中能表示KNO3溶解度曲线的是_____(选填“A”或“B”)
(2)由表中数据分析可知,20℃时40gNaC1溶解在50g水中得到溶液_____g。
(3)硝酸钾中含有少量氯化钠时,可通过_____(选填“蒸发结晶”或“降温结晶”)的方法提纯。