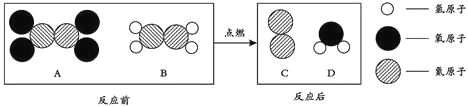
题目内容
【题目】实验室有100g废液,其中含有硫酸铜、硫酸亚铁、硫酸锌。现对废液进行处理,得到铜和硫酸锌溶液,实验流程如下图所示。
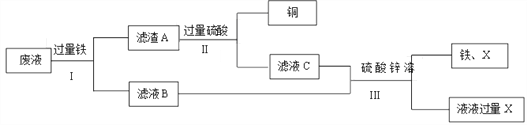
(1)步骤I、II、III中均包含的操作名称是____。
(2)滤液B中的溶质是____________________。(填化学式)
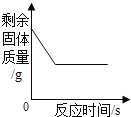
(3)当观察到_________时,说明滤渣A中铁已经完全反应。
(4)步骤III中加入的X是________。 (填化学式)
【答案】 过滤 FeSO4、 ZnSO4 气泡不再产生 Zn
【解析】根据所学知识和题中信息知,100g废液,其中含有硫酸铜、硫酸亚铁、硫酸锌。现对废液进行处理,得到铜和硫酸锌溶液。铁与硫酸铜反应置换出铜,(1)步骤I、II、III中均包含的操作名称是过滤,过滤是把不溶于液体的固体物质与液体分离的一种方法。(2) 铁与硫酸铜反应置换出铜,铁过量,滤液B中的溶质是FeSO4、 ZnSO4。 (3)当观察到气泡不再产生时,铁与硫酸反应产生氢气,说明滤渣A中铁已经完全反应。(4)步骤III中加入的X是Zn,锌比铁活泼,可以置换出硫酸亚铁中的铁。
点睛∶过滤是把不溶于液体的固体物质与液体分离的一种方法。金属的活泼性Zn>Fe>Cu。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】化学实验不仅能提高同学们对化学学习的乐趣,更能提高动手能力。
(1)某化学小组用厨房里的物质进行以下实验,合理的是_____。
A 用食醋浸泡除去水壶里的水垢 B 用铁刷清洗铝锅上的油渍
C 用食盐水检验自来水的酸碱性 D 用打火机检验煤气是否泄漏
(2)该小组在社会实践活动中,考察了某工厂的废水(无色)处理流程,并取该厂未经处理的废水样品进行测定
①用紫色石蕊溶液检验废水的酸碱性,石蕊溶液呈红色,于是该兴趣小组确定该废水中一定含有_____(填离子符号)
②另取该废水少量,滴加适量Ba(NO3)2溶液,有白色沉淀产生,说明该废水中一定含有的酸根离子是_____。
③活动后小组同学推测该厂废水处理时可以加入_____,使废水达到中性后再排放。
(3)已知该工厂废水中除含有以上离子外,还含有Mg2+,该兴趣小组继续进行探究,验证废水中含有Mg2+,进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取少量废液于试管中,向试管中逐滴滴加NaOH溶液 | 刚开始试管中_____;一会儿可以看到试管中_____。 | 废液中含有Mg2+ |
写出有关反应的化学方程式_____(写一个即可)。
(4)乙炔(C2H2)是一种重要的化工原料。常用碳化钙(CaC2)与水反应制取乙炔,同时产生氢氧化钙。若要制取1.3g乙炔气体,理论上需要碳化钙的质量是多少_____?