题目内容
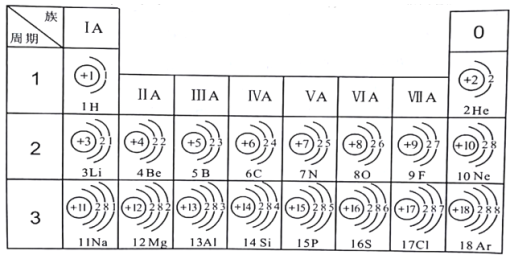
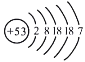
【题目】由下面粒子结构示意图得出的结论不正确的是 ( )

A. ②③属于同种元素B. ①②均易形成阴离子
C. ③④⑤属于离子D. ⑥是镁原子结构示意图
【答案】C
【解析】
A、决定元素种类的是原子的核内质子数或核电荷数,由于②和③核内质子数都是9,所以属于同种元素,故A正确;
B、最外层电子数大于4易得到电子,变成阴离子,因为①和②的最外层电子数都大于4,均易形成阴离,故B正确;
C、带电的原子或原子团叫做离子,离子的核内质子数不等于核外电子数,由微粒的结构可知,③⑤的质子数等不等于电子数,属于离子,④的核内质子数等于核外电子数,属于原子,故C错误;
D、镁原子核内质子数为12,⑥的质子数=电子数=12是镁原子结构示意图,故D正确。故选C。

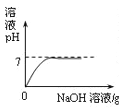
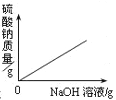
【题目】向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是
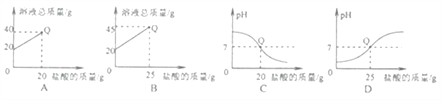
A. A B. B C. C D. D
【题目】为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数,进行如下实验:
①取200g混合溶液加入足量的AgNO3溶液,经过滤、洗涤、干燥、称量,得到143.5gAgCl固体;②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别 | 一 | 二 | 三 | 四 | 五 |
混合溶液质量/g | 200 | 200 | 200 | 200 | 200 |
铁屑质量/g | 6 | 9 | 12 | 15 | 18 |
析出铜的质量/g | 6.4 | 9.6 | m | 16 | 16 |
请分析计算:
(1)表中第三组实验的m值为_______。
(2)第_____组实验恰好完全反应。
(3)铁屑中铁的质量分数为多少___________?(计算结果精确到0.1%)
(4)原混合溶液中FeCl2的质量分数为多少______________?(计算结果精确到0.1%)