题目内容
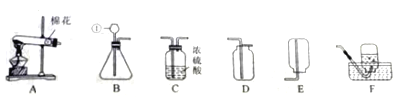
【题目】某同学设计如下实验装置探究一氧化碳的一些化学性质。试回答下列问题:

(1)A装置的目的是___,所发生的反应的化学方程式____,该反应属于_______(填“吸热”或“放热”)反应。
(2)装置B中足量的石灰水的作用是__,其反应方程式是___,装置D中石灰水的作用是_____。
(3)装置C中实验现象是___,此装置中所发生的化学反应方程式是__,证明一氧化碳有___性。
(4)根据本实验,点燃装置E中尾气的目的是____,这是利用了物质的__性。
【答案】产生一氧化碳 C+CO2![]() 2CO 吸热 除去剩余的二氧化碳 CO2+Ca(OH)2═CaCO3↓+H2O 检验一氧化碳与氧化铜反应生成二氧化碳 黑色粉末逐渐变成光亮的红色 CO+CuO
2CO 吸热 除去剩余的二氧化碳 CO2+Ca(OH)2═CaCO3↓+H2O 检验一氧化碳与氧化铜反应生成二氧化碳 黑色粉末逐渐变成光亮的红色 CO+CuO![]() Cu+CO2 还原 防止污染空气 可燃
Cu+CO2 还原 防止污染空气 可燃
【解析】
(1)实验的目的是要探究一氧化碳的一些化学性质,可以通过碳和二氧化碳在高温下的反应制取一氧化碳;所以,A装置的目的是制取一氧化碳,所发生的反应的化学方程式:C+CO2![]() 2CO,该反应属于吸热反应;
2CO,该反应属于吸热反应;
(2)在制取的一氧化碳中有未反应的二氧化碳,为了避免对一氧化碳与氧化铜反应生成二氧化碳的判断的干扰,应除去;所以,装置B中足量的石灰水的作用是除去未反应的二氧化碳,其反应方程式是CO2+Ca(OH)2═CaCO3↓+H2O,装置D中足量的石灰水的作用是检验二氧化碳;
(3)一氧化碳与氧化铜在加热的条件下反应,生成了铜和二氧化碳。所以,装置C中实验现象是:黑色粉末变成红色固体;此装置中所发生的化学反应方程式是:CO+CuO![]() Cu+CO2,证明一氧化碳有还原性;
Cu+CO2,证明一氧化碳有还原性;
(4)由于一氧化碳有毒,能污染空气;所以,点燃装置E中尾气的目的是防止尾气中的一氧化碳污染空气,这是利用了物质的可燃性。

【题目】(1)不同实验对反应速率有不同要求。某同学探究CO2制取实验,按要求答题。
限选控制反应速率的方法:
①反应物的浓度 ②反应物的状态
限选试剂:
A.稀盐酸 B.浓盐酸 C.块状石灰石 D.碳酸钠溶液 E.粉末状石灰石
填写下表并回答相关问题。
实验名称 | 控制速率 的方法 | 所选用的 最佳试剂 |
灭火器反应原理 | ① | ________和D |
CO2的实验室制法 | ______ | A和C |
写出灭火器反应原理的化学方程式______
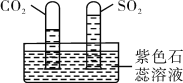
(2)已知:CO2和SO2既有相似性,又有差异性。
实验一:水槽中滴入紫色石蕊,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,说明相同条件下的溶解性:SO2___ (填“>”或“<”)CO2,试管内溶液变成_______。
实验二:已知镁条在CO2中剧烈燃烧的化学方程式为:2Mg+CO2![]() 2MgO+C,试推测镁条在SO2中燃烧的现象为:______
2MgO+C,试推测镁条在SO2中燃烧的现象为:______
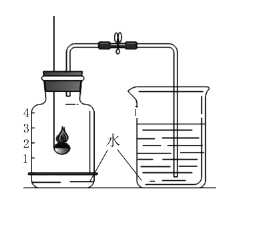
【题目】某化学兴趣小组用化学方法测定一种钢样品中铁的含量。同学们称取了11.4g钢样品,投入装有20.0g稀盐酸(足量)的烧杯中(烧杯质量也为20.0g)。在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,记录如下表:
反应时间 | t0 | t1 | t2 | t3 |
烧杯和药品的质量(克) | 51.4 | 51.2 | 51.0 | 51.0 |
(1)反应中产生氢气____________克。
(2)这种钢样品中铁的质量分数是______________?(精确到0.1﹪)