题目内容
【题目】小明同学在实验室用蒸馏水新配制了质量分数为20%的氢氧化钠溶液和饱和石灰水各一瓶,忘记贴上标签,与一瓶末贴标签的蒸馏水混在一起。
[实验探究]
探究一 鉴别三瓶液体
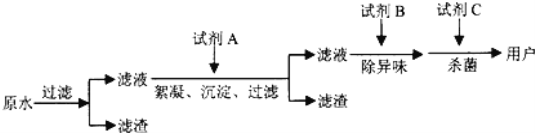
为帮助小明鉴别三种液体,小组同学建议用气体压力传感器进行实验,并设计了如图装置。

实验步骤:
步骤1:如图1所示装置的气密性良好,三瓶250mL的烧瓶内收集满CO2气体,三个注射器内各装有等体积的三种液体。连接好装置和压强传感器。
步骤2:三位同学同时迅速将注射器内等体积的三种液体注入各自烧瓶中,关闭活塞。
步骤3:一段时间后,同时振荡烧瓶。观察传感器定量实时传回烧瓶内气压变化形成的图象情况如图2所示。
实验结论:根据图2对比三根曲线,得出曲线1、2、3分别对应的是蒸馏水、饱和石灰水、氢氧化钠溶液。
交流讨论:
(1)曲线1中起点和终点的压强大约相等,说明通常状况下二氧化碳_____(填“难溶”、“易溶”、“能溶”)于水。曲线2对应烧瓶中看到的现象为_____。曲线3发生的化学方程式是_____。
(2)步骤3“一段时间后,同时振荡烧瓶”,从曲线判断“一段时间”指_____s(填图2中提供的数字)。
探究二 验证二氧化碳与氢氧化钠发生反应
设计实验:为验证二氧化碳与氢氧化钠溶液发生了反应,兴趣小组同学设计了图3装置。
(3)第一步:检查装置气密性,具体方法是_____;第二步:装药品。关闭止水夹,将注射器内的氢氧化钠溶液全部注入充满二氧化碳的集气瓶,充分振荡后,打开止水夹,若看到_____现象,证明二氧化碳与氢氧化钠溶液发生了反应。
交流讨论:
(4)小明同学认为,将氯化钡溶液换成氢氧化钙溶液,也可以由上述现象得出“二氧化碳与氢氧化钠溶液发生反应”的结论,你的观点是_____。
(5)小明同学认为若没有图3中右边装置,只要提供一种与氯化钡物质分类不同的溶液,也可以证明“二氧化碳与氢氧化钠溶液发生反应”,这种溶液是_____。
数据处理:
(6)图3中集气瓶内容积为224mL,通常情况下224mL二氧化碳的质量为0.44g,注射器内氢氧化钠溶液全部注入集气瓶充分振荡后,集气瓶内气体压强为0.试计算,注射器内至少要盛有多少克20%氢氧化钠溶液?(写出计算过程)_____。
[拓展应用]
(7)若需要除去一氧化碳中的少量二氧化碳,一般选择氢氧化钠溶液,而不宜选择氢氧化钙溶液的原因是_____。
【答案】能溶 产生白色沉淀(或溶液变浑浊) CO2+2NaOH═Na2CO3 +H2O 800 向下推活塞,松开回到原刻度(合理皆可) 右瓶液体进入左瓶,有白色沉淀生成(提到白色沉淀即可,无不给分) 不能换,二氧化碳与氢氧化钙溶液也有白色沉淀(类似答案皆可) 稀盐酸(常见的酸皆可,碱、盐不得分) 4g 氢氧化钙微溶于,不一定完全吸收二氧化碳
【解析】
(1)曲线1中起点和终点的压强大约相等,说明通常状况下二氧化碳能溶于水;氢氧化钙能和二氧化碳反应生难溶性的碳酸钙,烧瓶中看到的现象为生成白色沉淀;二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式为:CO2 +2NaOH═Na2CO3 +H2O;
(2)从曲线判断“一段时间”指800s;
(3)根据装置的特征可用以下方法进行检查装置的气密性:向下推活塞,松开回到原刻度;二氧化碳和氢氧化钠反应,使瓶内压强降低,打开止水夹,右瓶液体进入左瓶,有白色沉淀生成;
(4)因为二氧化碳能和氢氧化钙反应生成不溶于水的碳酸钙,干扰碳酸钠的检验,故不能换,二氧化碳与氢氧化钙溶液也有白色沉淀;
(5)碳酸钠能与酸反应生成二氧化碳,故把氯化钡溶液换成稀盐酸也能观察到明显的现象,能够证明二氧化碳与氢氧化钠溶液发生反应;
(6)设0.44g二氧化碳完全反应需要氢氧化钠的质量为x,
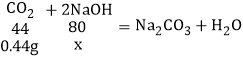
![]()
x=0.8g,
需要20%的氢氧化钠溶液的质量为:![]() =4g;
=4g;
(7)氢氧化钙微溶于水,所得溶液的浓度过低,不一定完全吸收二氧化碳,要除去二氧化碳一般用浓度大的氢氧化钠溶液。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】小明同学对所学部分化学知识归纳如下。其中不正确的是( )
A | 须辨清的物质 | B | 初中化学中常见的“三” |
干冰不是冰﹣而是固体CO2 纯碱不是碱﹣而是盐 | 三种常见还原剂CO、H2、C 三种基本粒子﹣﹣原子、分子、离子 | ||
C | 化学巨匠及其杰出贡献 | D | 符号中数字“2”的意义 |
张青莲﹣测量相对原子质量 侯德榜﹣﹣发明联合制碱法 |
2O:两个氧原子 |
A. AB. BC. CD. D
【题目】金属材料包括纯金属以及它们的合金。
(1)在金属中加热熔合某些___,就可以制得具有金属特征的合金。
(2)铁制品锈蚀的过程,实际上是铁与空气中的___发生化学反应的过程。
(3)焊锡(锡铅合金)主要用于焊接金属,武德合金(铅、铋、锡和镉组成的合金)可用于制电路保险丝。根据下表提供的数据,可知合金的熔点一般___。
金属材料 | 纯金属 | 合金 | ||||
铅 | 镉 | 铋 | 锡 | 焊锡 | 武德合金 | |
熔点/℃ | 327 | 321 | 271 | 232 | 183 | 70 |
(4)1756年,俄国化学家罗蒙诺索夫把锡(Sn)放在密闭容器里煅烧,发现容器和容器里的物质的总质量在煅烧前后并没有发生变化。
①锡煅烧生成一种氧化物,其中锡元素的化合价为+4,该氧化物的化学式为___。
②罗蒙诺索夫认为在化学变化中物质的质量是守恒的。除了物质的质量以外,化学反应前后肯定没有变化的是___(填字母)。
A 原子数目 B 分子数目 C 原子种类 D 元素种类
(5)铁与硫酸铜溶液的反应在质量守恒定律的验证中起着重要的作用。若1.4g铁粉能与50g硫酸铜溶液恰好完全反应,则该硫酸铜溶液中溶质的质量分数是___?(写出计算过程)
【题目】如图,把胶头滴管里的液体挤入锥形瓶内时,U形管中的红墨水左低右高。分析液体和固体分别是什么物质,填入下面表格内。(要求写出三种情况)
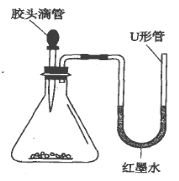
液体 | 固体 | |
① | _____ | _____ |
② | _____ | _____ |
③ | _____ | _____ |