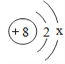题目内容
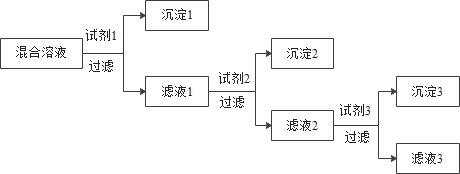
【题目】铝土矿的主要成分是氧化铝(所含杂质不参与反应,也难溶于水),工业上用铝土矿制取金属铝的过程如下图所示,请你回答以下问题:
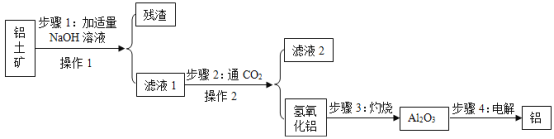
(1)步骤1中发生如下反应:Al2O3+2NaOH═2NaAlO2+X,X的化学式是__.
(2)操作1和操作2中均用到玻璃棒,其作用是__,滤液2的PH为10显__性(填“酸或碱”).
(3)步骤2得到的氢氧化铝可以用于治疗胃酸过多,该反应属于__反应(填“化合、分解、复分解”).
(4)步骤3中发生了分解反应,除了生成氧化铝,还有一种氧化物生成.请写出该反应的化学方程式__.
【答案】H2O 引流 碱 复分解 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
(1)根据化学反应前后原子的种类和数目不发生改变,在反应前铝原子有2个,钠原子有2,氧原子有5个,氢原子有2个,而反应后铝原子有2个,钠原子有2,氧原子有4个,氢原子没有,可判断物质X的每个分子由2个H原子构成、1个氧原子构成,则物质X的化学式为H2O;故填:H2O。
(2)操作1和操作2中均为过滤操作,用到玻璃棒,其作用是引流,滤液2的pH为10>7,显碱性;故填:引流;碱。
(3)步骤2得到的氢氧化铝可以用于治疗胃酸过多,它与胃酸反应的化学方程式是 3HCl+Al(OH)3═AlCl3+3H2O,该反应符合“两种化合物相互交换成分,生成另外两种化合物”的特点,属于复分解反应。故填:复分解。
(4)步骤3中灼烧发生分解反应,根据“除了生成氧化铝,还有一种常见的氧化物生成”,根据质量守恒定律,推测“一种常见的氧化物”为水,则该反应的化学方程式为2Al(OH)3![]() Al2O3+3H2O。故填:2Al(OH)3
Al2O3+3H2O。故填:2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。

练习册系列答案
相关题目