题目内容
【题目】氧是地壳中含量最多的元素。
(1)氧的原子结构示意图如图所示:
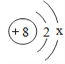
①x=________。
②氧原子在化学反应中易________(填“得到”或“失去”)电子。
(2)用化学用语填空:
①氧离子:___________; ②氧化镁:____________。
(3)在降温和加压的条件下,氧气由气体变成液体体积减少。用微粒的观点解释:___________。
(4)某变化的微观示意图如下所示。
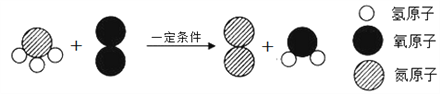
该反应的化学方程式为_________________________________。
【答案】 6 得到 O2- MgO 氧分子间的空隙变小 4NH3 + 3O2 ![]() 2N2 + 6H2O
2N2 + 6H2O
【解析】(1)①在原子中核内质子数等于核外电子数,所以x=82=6;②氧原子的最外层电子数是6,大于4,在化学反应中易得到电子;(2)①氧离子带两个单位的负电荷,符号为:O2;②氧的化合价为2价,镁的化合价为+2价,氧化镁的化学式是:MgO; (3)在降温和加压的条件下,氧分子的间隔变小了,所以氧气由气体变成液体,体积变小;(4)由化学变化前后的微观示意图可知,该反应是氨气燃烧生成了氮气和水,反应的化学方程式是: ![]()
![]()
![]() 。
。

【题目】氢氧化钠是重要的工业原料,以下是有关它的性质实验.
(1)如图1所示,反应后溶液(编号为 a)中溶质的组成情况可能有种.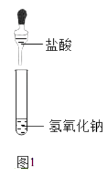
为证明溶液 a 中可能含有的溶质,进行了如下实验:
①确定溶液 a 中是否含有氢氧化钠
步骤 | 现象 | 结论 |
取少量溶液a,滴加氯化铜溶液 | 不含氢氧化钠 |
②确定溶液a中是否含有盐酸
方案 | 步骤 | 现象 |
一 | 取少量溶液a,滴加硝酸银溶液 | 产生白色沉淀 |
二 | 取少量溶液a,加入镁粉 | 产生气泡 |
i.上述方案中有一个设计不合理,指出不合理的实验方案编号及原因、;
ii.采取正确的实验方案,进行实验,根据现象得到的结论是;ⅲ.欲从溶液a中得到纯净的氯化钠,可以采取的实验操作是 .
(2)利用如图2装置验证氢氧化钠能与二氧化碳反应.(装置气密性良好)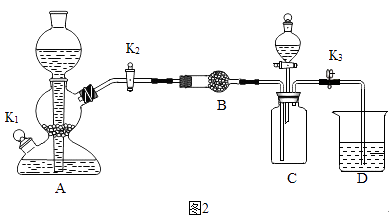
①装置A用于制取二氧化碳,打开K2、K3 , 当D中紫色石蕊试液变色,可确定C中收集满二氧化碳.
②甲同学打开装置 C 中分液漏斗活塞,将 8mL 室温时氢氧化钠饱和溶液滴入 C 中,然后关闭活塞,观察到 D 中石蕊试液倒流至 C 中.甲同学得出结论,氢氧化钠能与二氧化碳反应.
③乙同学认为上述现象不足以证明氢氧化钠能与二氧化碳发生反应,还应利用上述装置补充一个对比实验.
液体 | 步骤 | 现象 |
打开分液漏斗活塞,加入液体后关闭活塞 |
结论:氢氧化钠能与二氧化碳反应,写出该反应的化学反应方程式 .
