题目内容
【题目】含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途.
Ⅰ.以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O)的流程如图.
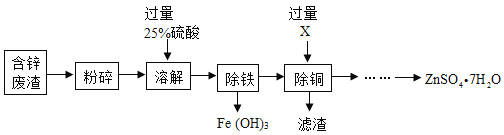
(1)粉碎的目的是_________.
(2)若实验室用质量分数为98%的硫酸配制200g 25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、_______和________,此处玻璃棒的作用是___________.
(3)物质X是________,滤渣中含有金属单质有_______,除铜时发生的反应方程式为________.
(4)流程中获得七水硫酸锌前省略的操作是_________、冷却结晶、_________、洗涤和低温烘干.
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化学式是_______.
【答案】增大反应物的接触面积,加快反应的速率 烧杯 量筒 搅拌加快散热 锌 铜、锌 Zn+CuSO4=ZnSO4+Cu 一定条件下制成硫酸锌的饱和溶液或蒸发浓缩 过滤 Fe3O4
【解析】
反应物接触面积越大,反应速率越快;浓硫酸溶于水放热;锌和硫酸铜反应生成硫酸锌和铜。
(1)粉碎的目的是增大反应物接触面积,加快反应速率。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、烧杯和量筒,玻璃棒的作用是搅拌加快散热。
(3)锌能和硫酸铜反应生成硫酸锌和铜,可以把硫酸铜除去,物质X是锌,滤渣中含有金属单质有过量的锌和反应生成的铜,除铜时发生的反应方程式为Zn+CuSO4=ZnSO4+Cu。
(4)流程中获得七水硫酸锌前省略的操作是加热条件下制成硫酸锌的饱和溶液或蒸发浓缩、冷却结晶、过滤、洗涤和低温烘干。
(5)设铁的氧化物的化学式是FexOy
![]()
![]()
故氧化物的化学式是Fe3O4。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】(1)今天是化学实验室开放日,老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体,我们对此气体展开了一系列探究:
①此气体是什么物质?验证它的实验方案如下:
猜想与假设 | 实验步骤 | 现象及结论 |
此气体可能是______ | __________ | ________ |
产生此气体的化学方程式可能是__.
②我想制取该气体,采用的发生装置和收集装置可选取如图甲中的______(填序号)。
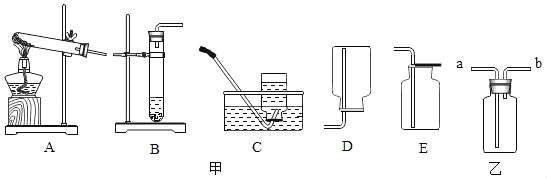
③如图乙装置收集该气体,气体由_________端(填“a”或“b”)导入.
(2)某校化学兴趣小组同学在实验室整理药品时,发现氢氧化钠溶液的试剂瓶未塞瓶塞,且试剂瓶口周围有一些白色固体,他们怀疑氢氧化钠已经变质,于是进行了如下实验探究
(提出问题)氢氧化钠是否变质?
(查阅资料)氯化钠溶液、氯化钡溶液呈中性.
(实验探究)小王、小李两同学分别设计了不同方案并加以实验.
实验操作 | 实验现象 | 实验结论 | |
小王 | 用pH试纸测溶液的pH | 溶液的pH>7 | 说明氢氧化钠溶液没有变质 |
小李 | 取少量溶液于试管中,加入适量氯化钡溶液 | A | 说明氢氧化钠溶液已经变质 |
(1)小李同学认为小王同学的结论不科学,其理由是_________.
(2)小李同学的实验中观察到实验现象A为___________.
(3)小张同学认为该氢氧化钠溶液只是部分变质,于是对小李同学的实验进行如下改进:向试管中加入过量的氯化钡溶液,目的是_________,然后再向溶液中加入__________,通过观察溶液颜色的变化,说明溶液中含有氢氧化钠.
(4)小王同学在测定溶液pH实验中,由于紧张先将pH试纸润湿后再去测氢氧化钠溶液的pH,你认为他测出该溶液的pH会________(填“偏大”“偏小”或“不变”)。