题目内容
【题目】学习碳酸钠知识时,老师做碳酸钠溶液和澄清石灰水反应演示实验,并对浑浊液过滤,得到澄清滤液。课堂上老师的提问和同学们的回答如下图所示:
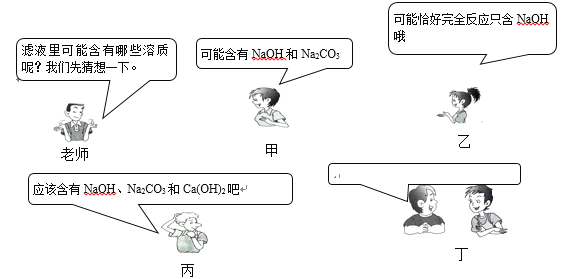
(1)假设你是丁同学,请你也提出一个与甲、乙、丙同学不同的猜想,把猜想写在对话框中____。并对你自己的猜想设计一个简单的实验加以证明。
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,____ | _____ | 自己的猜想成立 |
(2)你认为甲、乙、丙同学的猜想都合理吗?____如有不合理的请说明理由。_____。
(3)甲同学针对自己的猜想进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气体产生 | 甲的猜想不成立 |
你认为甲同学的实验设计是否正确?请说明理由____。
【答案】可能含有NaOH和Ca(OH)2 通入CO2气体或滴加碳酸钠溶液 试管中出现白色浑浊 丙同学的猜想不合理 因为Na2CO3与Ca(OH)2要发生反应,不可能共存 不正确,反应后滤液中一定有NaOH存在,盐酸先与氢氧化钠反应,滴入盐酸的量很少,即使有Na2CO3存在,也不会有CO2气体放出
【解析】
(1)甲同学的猜想:反应后滤液中一定会有氢氧化钠存在,若碳酸钠过量,则滤液中含有NaOH和Na2CO3;
乙同学的猜想:若该反应恰好完全反应,则滤液中只有NaOH;
丙同学的猜想:反应后滤液中一定会有氢氧化钠存在.若碳酸钠过量或氢氧化钙过量,则滤液中含有NaOH、Ca(OH)2和Na2CO3;
故丁同学的猜想是:反应后滤液中一定会有氢氧化钠存在.若氢氧化钙过量,则滤液中含有NaOH和Ca(OH)2;
因为碳酸钠和氢氧化钙反应一定生成氢氧化钠,所以只需证明溶液中是否有氢氧化钙就可以了,氢氧化钙与二氧化碳和可溶性的碳酸盐反应会生成沉淀,所以可以根据氢氧化钙的这些性质设计实验进行证明;方案如下:取样于试管中,滴加碳酸钠溶液或通入二氧化碳气体;试管中出现白色浑浊,自己的猜想成立;
(2)该滤液中不可能同时含有Na2CO3和Ca(OH)2,因为Na2CO3和Ca(OH)2会发生反应(两者不能共存);
(3)要证明碳酸钠的存在,涉及到的就是碳酸盐的检验,所以可以采用加酸的方法,由于滤液中含有氢氧化钠,因此需要加入足量的盐酸,只加入几滴盐酸,反应进行的不彻底,不能依据此判断滤液中不含碳酸钠;甲同学的实验设计不正确?其理由是反应后滤液中一定有NaOH存在,盐酸先与氢氧化钠反应,滴入盐酸的量很少,即使有Na2CO3存在,也不会有CO2气体放出

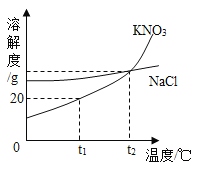
【题目】某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究
(提出问题)二氧化碳是与氢氧化钠反应,还是微溶于水中?
(查阅资料)①15℃时,101KPa时,二氧化碳的溶解度如表;
溶剂 | 水 | 酒精 |
溶解度 | 1.0 | 0.3 |
②15℃时,在酒精中,氢氧化钠易溶,碳酸钠微溶.
③通常情况下,稀溶液的体积约等于溶剂的体积.
(实验设计)在15℃、101KPa时,制取二氧化碳并用于实验

(分析与表达)
(1)如果二氧化碳与氢氧化钠反应,化学方程式是__,那么氢氧化钠应__保存.
(2)实验前,两套装置都进行了气密性检查.实验乙装置气密性检查的方法是__.
(3)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是__.
(4)实验乙中,将氢氧化钠溶液完全滴入锥形瓶中,注射器活塞会自动向内移动并将酒精推入锥形瓶中,还可能观察到的现象是__.
(5)实验乙结束后,注射器中酒精体积为20mL,则锥形瓶和胶头滴管中剩余的二氧化碳体积为__mL,与氢氧化钠反应的二氧化碳体积为__mL.
【题目】如图是某燃气热水器的内部构造示意图。
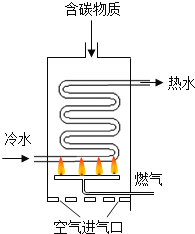
(1)热水器用天然气为燃气,天然气属于________(填“可再生”或不可再生)能源。燃气热水器中的热交换器采用了回形管结构,其优点是___________。
(2)热值是指1kg某种燃料完全燃烧放出的热量,常见三种燃料的热值及1kg燃料燃烧产生的CO2和SO2的质量如下表。结合下表数据以上三种燃料中最清洁高效的能源是天然气,理由是____________。
燃料 | 燃烧产物的质量/g | |
二氧化碳 | 二氧化硫 | |
汽油 | 2900 | 5.0 |
天然气 | 2500 | 0.1 |
煤 | 2500 | 11.0 |
(3)目前,人民利用高粱等富含淀粉的农作物制备酒精,淀粉先在酶的作用下转化为葡萄糖,葡萄糖(化学式:C6H12O6)在酒化酶的作用下生成酒精和造成温室效应的气体,请写出葡萄糖转化为酒精的化学方程式:_____________。