题目内容
【题目】汽车是现代生活中重要的交通工具。请回答下列问题:
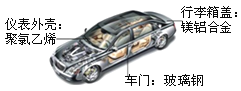
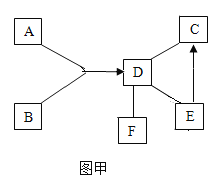
(1)图材料中属于金属材料的是___________。汽车电路中的导线一般为铜芯线,这是利用了金属铜的延展性和______性。
(2)将镁铝合金与铝片相互刻画,在铝片表面留下明显划痕,说明镁铝合金的硬度_______铝的硬度(填“大于”或“小于”)。
(3)汽车表面喷漆,可以延缓汽车的锈蚀,其防锈原理是__________________。
(4)某汽修厂清洗汽车零件后的废液中常含有一定量的AgNO3和Cu(NO3)2。向一定质量的该废液中[假设溶质只含AgNO3和Cu(NO3)2]中加入Zn,充分反应。
①写出Zn与AgNO3溶液反应的化学方程式____________________。
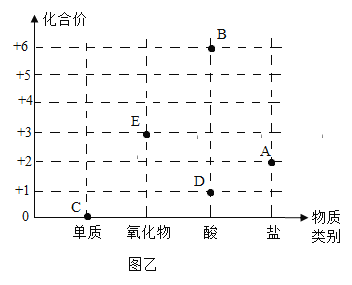
②溶液质量与加入Zn的质量关系如图所示,下列说法正确的是______________。
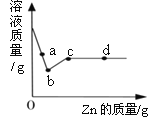
A 取a点溶液,溶质为Zn(NO3)2 、Cu(NO3)2 和AgNO3
B 若取b~c段固体,滴加稀盐酸,有气泡产生
C c点溶液中溶质为Zn(NO3)2
D 取d点的固体,加入稀盐酸,有气泡产生
【答案】镁铝合金 导电性 大于 隔绝氧气和水 Zn+2AgNO3=2Ag + Zn(NO3)2 ACD
【解析】
(1)图1材料中属于金属材料的是镁铝合金。金属具有导电性,汽车电路中的导线一般为铜芯线,这是利用了金属铜的延展性和导电性。
(2)将镁铝合金与铝片相互刻画,在铝片表面留下明显划痕,说明镁铝合金的硬度大于铝的硬度。
(3)汽车表面喷漆,可以将铁制品隔绝氧气和水,延缓汽车的锈蚀。
(4)在金属活动性顺序中,Zn>Cu>Ag,向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,与两种溶质依次发生反应
![]()
所以析出银的过程是溶液质量减少的过程;
![]()
所以析出铜的过程是溶液质量增加的过程。
①Zn与AgNO3溶液反应生成了硝酸锌和银,反应的为:Zn+2AgNO3=2Ag + Zn(NO3)2。
②A、在a点时,硝酸银没有全部参加反应,溶液中含有溶质为Zn(NO3)2、Cu(NO3)2和AgNO3,故选项正确;
B、b~c段是硝酸银全部参加反应完后锌和硝酸铜反应的过程,固体为银和铜,不能与稀盐酸反应,没有气泡产生,故选项错误;
C、c点是锌与硝酸铜恰好反应,溶液中溶质为Zn(NO3)2,故选项正确;
D、d点时锌过量,加入稀盐酸,有气泡产生,故选项正确。故选ACD。

【题目】为了测定某生理盐水的溶质质量分数,将生理盐水样品与足量的硝酸银溶液混合,有关实验数据如下表:
反应前 | 反应后 | ||
实验 数据 | 生理盐水样品的质量 | 加入硝酸银溶液的质量 | 过滤后剩余溶液的质量 |
130 g | 40 g | 167.13 g | |
(1)反应后生成氯化银的质量为 g。
(2)生理盐水的溶质质量分数为多少?________
【题目】学习碳酸钠知识时,老师做碳酸钠溶液和澄清石灰水反应演示实验,并对浑浊液过滤,得到澄清滤液。课堂上老师的提问和同学们的回答如下图所示:
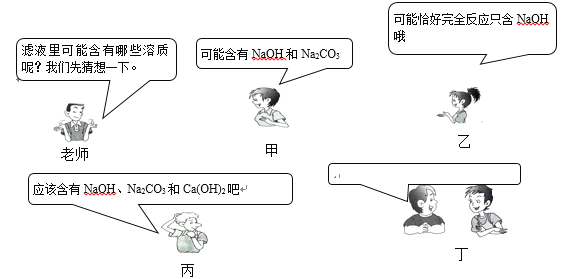
(1)假设你是丁同学,请你也提出一个与甲、乙、丙同学不同的猜想,把猜想写在对话框中____。并对你自己的猜想设计一个简单的实验加以证明。
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,____ | _____ | 自己的猜想成立 |
(2)你认为甲、乙、丙同学的猜想都合理吗?____如有不合理的请说明理由。_____。
(3)甲同学针对自己的猜想进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气体产生 | 甲的猜想不成立 |
你认为甲同学的实验设计是否正确?请说明理由____。