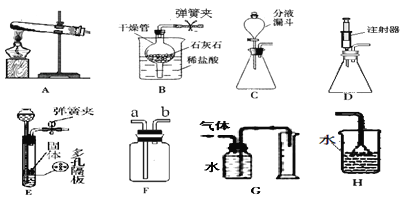
题目内容
【题目】(8分)石灰石有许多重要的用途。
(1)以石灰石为原料,可以生产生石灰,生石灰可做干燥剂,某化学兴趣小组的同学对食品厂某批次包装完整、粉状的生石灰成分进行质量检测。
【提出问题】该批次的生石灰成分及含量是否与标签相符?
(标签如图所示)

【猜想与假设】固体成分为:
A:全部是碳酸钙和杂质 B:既有碳酸钙,也有氧化钙和杂质
C:全部是 和杂质。
【设计并完成实验】
实验操作 | 实验现象 | 实验结论 |
第一步操作:取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液 | 溶液变红 | 说明固体成分中一定含有 |
第二步操作:再取少量固体于另一试管中滴加过量稀盐酸 | 有气泡生成 | 说明固体成分中一定含有 |
【实验结论】该兴趣小组同学得出的结论:剩余固体成分与【猜想与
假设】中的 (填A、B或C)相同。
【定量测定】称取10克该批次的生石灰样品,置于锥形瓶中,向其中缓慢加稀盐酸,直至无气泡产生,电子天平读数变小0.88克,将锥形瓶中残留物进行过滤、洗涤、干燥,得到固体质量为0.2克。

【问题讨论】由于生石灰与酸反应放出热量,导致水蒸气随CO2一起从导管口逸出,这一因素使测得的生石灰的最终含量将 (选填“偏小”“偏大”或“无影响”)。反应生成的CO2也会代替原有的空气残留在锥形瓶中,这一因素对测定结果也有影响。
(2)实验小组的同学对实验室制取二氧化碳反应后的溶液进行了如下探究:
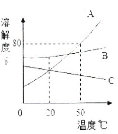
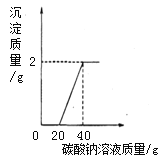
取大理石和盐酸反应且过滤后所得废液20克于烧杯中,逐滴滴入碳酸钠溶液至过量,滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系如图所示。请根据图中信息计算废液中氯化钙的质量分数是多少?(写出计算过程)
【答案】(1)氧化钙 氧化钙 碳酸钙 B 偏小
(2)11.1%
【解析】
试题分析:(1)【猜想与假设】因为氧化钙会与空气中的水反应生成氢氧化钙,而氢氧化钙会继续和空气中的二氧化碳反应生成碳酸钙,故探究分为三种情况,要不全部变质,要不部分变质,要不不变质,故猜想C:全部是氧化钙和杂质
【设计并完成实验】根据氧化钙会与水反应生成氢氧化钙,而氢氧化钠的水溶液显碱性,能使无色酚酞试液变红,故根据溶液变红,说明固体成分中一定含有氧化钙;由于碳酸钙会与稀盐酸反应,且产生二氧化碳,故第二步操作:再取少量固体于另一试管中滴加过量稀盐酸,现象有气泡生成,实验结论:说明固体成分中一定含有碳酸钙
【实验结论】根据上面的探究,固体中既有氧化钙,又有碳酸钙,故剩余固体成分与【猜想与假设】中的B相同
【问题讨论】由于生石灰与酸反应放出热量,导致水蒸气随CO2一起从导管口逸出,这样会使二氧化碳的质量偏大,根据化学方程式:CaCO3+2HCl==CaCl2+H2O+CO2↑计算出来的碳酸钙质量也偏大,那么生石灰的最终含量将偏小
(2)取大理石和盐酸反应且过滤后所得废液,加入碳酸钠溶液,结合滴入碳酸钠溶液的质量与生成沉淀的质量的变化关系,可判断原大理石和盐酸反应且过滤后所得废液中含有的溶质有:HCl、CaCl2,图像所显示的前段所加的20g碳酸钠溶液是与盐酸反应,故没有沉淀生成,后段所加的20g碳酸钠溶液才是与CaCl2反应,方程式为:CaCl2+Na2CO3==CaCO3↓+2NaCl,可根据方程式中CaCl2与CaCO3的质量关系,即可求出CaCl2的质量,进而可求出废液中氯化钙的质量分数
解:设CaCl2的质量为x
CaCl2+Na2CO3==CaCO3↓+2NaCl
100
x 2g
111:100=x:2g
X=2.22g
废液中氯化钙的质量分数=2.22g/20g×100%=11.1%

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】(9分)某面包膨松剂由碳酸氢钠和碳酸氢铵两种物质组成。化学小组为验证该膨松剂的成分及各成分含量的测定,通过查阅资料,设计如图所示实验。

查阅资料:①膨松剂在面包制作过程中发生的两个化学反应的方程式分别是:
2NaHCO3 △ Na2CO3+H2O+CO2↑
NH4HCO3 △ NH3↑+H2O+CO2↑
②通常状况下,1体积水溶解700体积氨气,氨气溶于水所得溶液为氨水
③二氧化碳溶于水,溶液呈酸性
实验定性验证:
操 作 步 骤 | 实 验 现 象 | 实 验 结 论 |
组装仪器, | ||
装入药品进行加热,打开阀 门 、关闭阀门 。 | 观察到 | 则说明有碳酸氢铵存在 |
然后打开阀门K2、关闭阀门 K1继续加热 | 最终观察到B中试管内没有气泡冒出,且____________ 。 | 则说明有碳酸氢钠存在 |
实验分析及反思:(1) 同学甲认为应将装置B中水换成澄清石灰水,才能判断样品的成分。
同学乙认为没有必要,他的理由是 。
(2) 请你分析装置C中碱石灰的作用是 。
实验数据分析及成分含量计算:
小组同学利用电子天平共同作了以下测定实验,实验数据记录如下:
称量项目 | 称量 时间 | 质量(g) |
装置A中试管质量 | 反应前 | 50.00 |
装置A中试管+样品质量 | 反应前 | 70.00 |
装置A中试管+固体质量 | 反应后 | 60.60 |
请你分析表中实验数据并计算该膨松剂中碳酸氢铵的质量分数。(写出计算的详尽过程)
解: