题目内容
【题目】燃烧是生活中常见的现象,它通常与空气中氧气有关。某校甲、乙两个化学兴趣小组围绕燃烧展开探究。
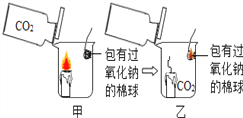
(1)甲组:探究可燃物异常燃烧的原因
大烧杯中盛有一只燃着的蜡烛和一团包有过氧化钠的棉花,将一瓶二氧化碳倒入烧杯中,蜡烛慢慢的熄灭,然后棉花突然剧烈的燃烧起来,这出乎意料的现象引起了同学们的极大兴趣,请参与同学们的讨论和探究。提出问题:棉花为什么会燃烧呢?
推理:棉花燃烧所需要的条件是_________________。
猜想与假设:①可能蜡烛燃烧引燃了棉花②可能二氧化碳和过氧化钠反应生成氧气③可能_____。
实验验证:
验证内容 | 操作 | 现象 | 结论 |
猜想① | 取上图甲中烧杯进行实验,点燃蜡烛,放置稍长时间(不倒入二氧化碳) | 棉球不燃烧 | 猜想①不成立 |
猜想② | 向盛满二氧化碳的集气瓶中撒入足量过氧化钠粉末,充分振荡后,将_________________; | ___________; | 猜想②成立 |
猜想③ | 向盛满二氧化碳的集气瓶中撒入足量过氧化钠,充分振荡后,用手触摸瓶壁 | ________; | 猜想③成立 |
(2)乙组:探究某可燃物的组成
将含碳氢元素的气态燃料1.6g放入足量氧气中燃烧,并使生成的气体全部通入如下图装置(忽略所有影响因素),实验中测得有关数据如下:(提示:干燥剂用于吸收水分)

实验前 | 实验后 | |
装置Ⅰ总质量 | 105.0g | 106.8g |
装置Ⅱ总质量 | 286.1g | 288.3g |
①验结束后生成二氧化碳的质量为﹙____﹚g;
②请通过计算确定该燃料中﹙______﹚﹙填是还是否﹚含有氧元素(写出计算过程,下同);
③根据二氧化碳中碳元素质量推算,理论上Ⅱ中能得到碳酸钙质量是﹙_______﹚克。
【答案】 与氧气(或空气)接触,温度达到可燃物的着火点 该反应放热 棉球不燃烧 将带火星木条伸入瓶中 木条复燃 2.2g 是 5g
【解析】(1)甲组:探究可燃物异常燃烧的原因。大烧杯中盛有一只燃着的蜡烛和一团包有过氧化钠的棉花,将一瓶二氧化碳倒入烧杯中,蜡烛慢慢的熄灭,然后棉花突然剧烈的燃烧起来。二氧化碳密度比空气大,本身不燃烧,不支持燃烧,可以用来灭火,二氧化碳与过氧化钠反应生成氧气,放出大量的热量,使棉花燃烧。推理:棉花燃烧所需要的条件是与氧气(或空气)接触,温度达到可燃物的着火点。猜想与假设:①可能蜡烛燃烧引燃了棉花②可能二氧化碳和过氧化钠反应生成氧气③可能该反应放热。
验证内容 | 操作 | 现象 | 结论 |
猜想① | 取上图甲中烧杯进行实验,点燃蜡烛,放置稍长时间(不倒入二氧化碳) | 棉球不燃烧 | 猜想①不成立 |
猜想② | 向盛满二氧化碳的集气瓶中撒入足量过氧化钠粉末,充分振荡后,将带火星木条伸入瓶中; | 木条复燃,二氧化碳与过氧化钠反应生成了氧气; | 猜想②成立 |
猜想③ | 向盛满二氧化碳的集气瓶中撒入足量过氧化钠,充分振荡后,用手触摸瓶壁 | 烫手,该反应放热; | 猜想③成立 |
(2)乙组:探究某可燃物的组成。含碳氢元素的气态燃料1.6g放入足量氧气中燃烧,并使生成的气体全部通入如下图装置。根据图表信息知,①二氧化碳与石灰水反应,生成二氧化碳的质量为∶288.3g-286.1g=2.2g,干燥剂吸收水分,生成是质量为∶106.8g-105.0g=1.8g。②二氧化碳中碳元素质量为∶2.2g×![]() ×100%=0.6g,水中氢元素质量为∶1.8g×
×100%=0.6g,水中氢元素质量为∶1.8g×![]() ×100%=0.2g, 1.6g>0.6g+0.2g, 通过计算确定该燃料中是含有氧元素。③根据二氧化碳中碳元素质量推算,理论上Ⅱ中能得到碳酸钙质量是∶C→CaCO3 ,12→1OO,
×100%=0.2g, 1.6g>0.6g+0.2g, 通过计算确定该燃料中是含有氧元素。③根据二氧化碳中碳元素质量推算,理论上Ⅱ中能得到碳酸钙质量是∶C→CaCO3 ,12→1OO, ![]() =
=![]() ,=5g。
,=5g。
点睛∶灵活应用质量守恒定律是顺利完成本题的重要保证。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案