题目内容
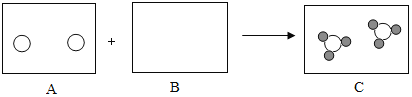
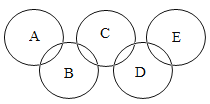
【题目】已知奥运五环中A、B、C、D、E为稀硫酸、氢氧化钠溶液、二氧化碳、氧化铁、水中的一种,且相连环内的两种物质能发生化学反应,E是常见的溶剂。请回答:
(1)B物质是__________,C物质俗称_____________。
(2)A与B反应的实验现象是________。
(3)写出C与D反应的化学方程式_____。
【答案】H2SO4 烧碱(火碱、苛性钠) 红色粉末消失(固体减少),溶液由无色变为黄色 ![]()
【解析】
E是常见溶剂,故E为水,D和水反应,故D为二氧化碳,C和二氧化碳反应,故C为氢氧化钠,B和氢氧化钠反应,故B为硫酸,最后剩下A为氧化铁。
(1)由分析可知,B为硫酸,C为氢氧化钠,故填:H2SO4;烧碱(火碱、苛性钠)。
(2)由分析可知A为氧化铁B为硫酸,氧化铁和硫酸反应生成硫酸铁和水,现象为红色粉末消失(固体减少),溶液由无色变为黄色,故填:红色粉末消失(固体减少),溶液由无色变为黄色。
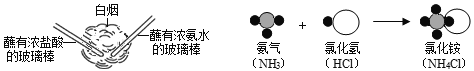
(3)由分析可知C为氢氧化钠,D为二氧化碳,氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为2NaOH+CO2=Na2CO3+H2O,故填:![]() 。
。

练习册系列答案
相关题目
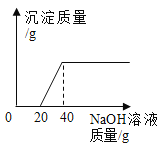
【题目】某课外小组同学为了测定石灰石中碳酸钙的质量分数,取某地石灰石样品9.0g于烧杯中,将50g稀盐酸分5次加入烧杯中,充分反应后![]() 杂质不与稀盐酸反应
杂质不与稀盐酸反应![]() ,测得剩余固体的质量记录如下。
,测得剩余固体的质量记录如下。
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸质量 | 10 | 10 | 10 | 10 | 10 |
剩余固体质量 | 7.0 | 5.0 | 3.0 | 1.8 | X |
请计算:
(1)X的值为______。
(2)该石灰石样品中碳酸钙的质量分数为______。
(3)所用稀盐酸溶质的质量分数。![]() 写出计算过程
写出计算过程![]()