��Ŀ����
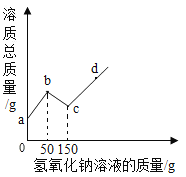
����Ŀ����ҵ�ϲ������ӽ���Ĥ���۵�ⱥ��ʳ��ˮ���ɵõ���Ũ�ȵ��ռ���Һ����NaOH 35%��48%����ij��ȤС������֤һ������������NaOH��Һ�Ƿ�ﵽ�˸�Ũ�ȱ������������²��������������㣺
��1����37%��Ũ��������200g7.3%�����ᣬ��Ҫ��ˮ���ܶ�Ϊ1gmL��1��_____mL��������������һλС����
��2���ɼ��û����������е�NaOH��Һ20g�������е��������Ƶ����ᣬ����Һ��pH=7ʱ����������100g���жϵ�����NaOH��Һ�Ƿ�ﵽ��Ũ�ȱ�_________����д��������̣�
���𰸡� 160.5 ������NaOH��Һ�ﵽ��Ũ�ȱ���
��������
����Ũ������ϡ�͵Ĺ��������ʵ������������������ˮ����������ҺpH=7˵���������ƺ�����ǡ����ȫ��Ӧ�������������������������Ƶ�������
��1����37%��Ũ��������200g7.3%�����ᣬ��Ҫ��ˮ������Ϊ![]() ������ˮ���ܶ�Ϊ1gmL1�������ۺ����Ϊ 160.5mL��
������ˮ���ܶ�Ϊ1gmL1�������ۺ����Ϊ 160.5mL��
��2��������������Һ�����ʵ���������Ϊx
NaOH��HCl��NaCl��H2O
40 36.5
20g![]() x 100g��7.3%
x 100g��7.3%
![]()
x��40%������35%��48%
���Ե�����NaOH��Һ�ﵽ��Ũ�ȱ�

��ϰ��ϵ�д�
�����Ŀ