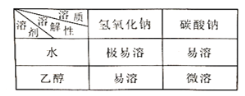
题目内容
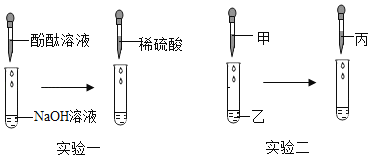
【题目】盐酸、硫酸和硝酸都是重要的酸,下列是探究酸性质的实验。

(1)能区分稀盐酸和稀硫酸的是____(选填“实验一”“实验二”),此实验中观察到的现象是___;
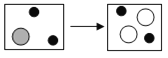
(2)若实验二中稀硫酸和硝酸钡溶液恰好完全反应,反应的化学方程式为___;如图是装有稀硫酸的试管中加入硝酸钡溶液前后主要离子种类及个数比变化示意图,则“![]() ”代表的离子是___(填离子符号);
”代表的离子是___(填离子符号);
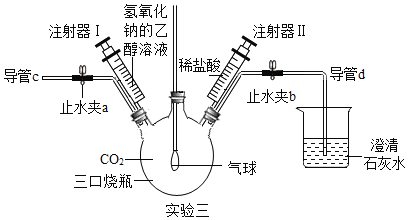
(3)实验三稀盐酸中无明显现象;稀硝酸中的现象为铜片逐渐溶解,溶液变蓝,并有气泡产生,反应为3Cu+8HNO3===3Cu(NO3)2+2X↑+4H2O,则X的化学式为___;
(4)实验室利用氢气还原氧化铜后,试管内壁上常附着一些铜,清洗方法是____。
【答案】 实验二 稀盐酸中没有明显现象,稀硫酸中有白色沉淀生成; H2SO4+Ba(NO3)2===BaSO4↓+2HNO3 H+; NO; 加入足量的稀硝酸充分反应后,用水清洗或先将试管中的铜加热成氧化铜后,然后将稀硫酸充分反应后,用水清洗
【解析】
(1)酸都能是紫色石蕊溶液变红色,实验一中现象完全相同,故不能区分,硫酸根离子和钡离子反应生成硫酸钡沉淀,而硝酸钡与稀盐酸不反应,所以能区分稀盐酸和稀硫酸的是实验二,此实验中观察到的现象是:稀盐酸中没有明显现象,稀硫酸中有白色沉淀生成;
(2)硫酸和硝酸钡反应生成硫酸钡沉淀和硝酸,化学方程式为H2SO4+Ba(NO3)2===BaSO4↓+2HNO3 ;硝酸钡与稀硫酸的反应中,钡离子与硫酸根离子反应生成了硫酸钡沉淀,氢离子和硝酸根离子没有参加反应,装有稀硫酸的试管中加入硝酸钡溶液前后氢离子没有改变,故 “![]() ”代表的离子是H+;
”代表的离子是H+;
(3)在反应3Cu+8HNO3===3Cu(NO3)2+2X↑+4H2O中,化学反应前后,元素种类、原子个数不变,反应物中有3个铜原子,8个氢原子,8个氮原子,24个氧原子,生成物中有3个铜原子,6个氮原子,22个氧原子,故2X中含有2个DNA原子和2个氧原子,所以X中含有1个氮原子和1个氧原子,故X是NO;
(4)铜的金属活动性排在氢的后面,不能与一般的酸反应,而硝酸具有氧化性,可以与铜反应,故实验室利用氢气还原氧化铜后,试管内壁上常附着一些铜,清洗方法是:加入足量的稀硝酸充分反应后,用水清洗或先将试管中的铜加热成氧化铜后,然后将稀硫酸充分反应后,用水清洗。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
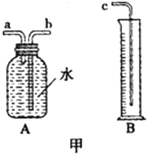
(1)图甲中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____管接c。
(2)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过______来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。