题目内容
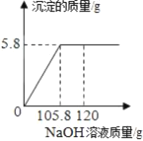
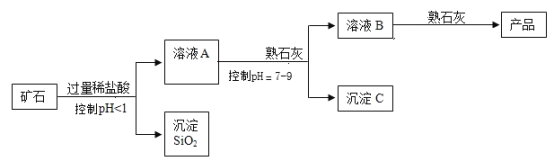
【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:
部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
(1)加入稀盐酸反应后分离溶液A与沉淀SiO2的方法是_______;
(2)沉淀C含有两种物质,按出现沉淀的先后顺序依次是(填化学式):__________、_________;
(3)溶液A中的阳离子是_______________(填离子符号);
(4)溶液B与熟石灰反应的化学方程式是_____________________________;
【答案】过滤 Fe(OH)3 Cu(OH)2 Mg2+、Fe3+、Cu2+、H+ MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
【解析】
(1)过滤可以将不溶性固体从溶液中分离出来,所以分离溶液A与沉淀SiO2的方法是过滤;
(2)控制pH值在7-9之间,氢氧化镁不能沉淀,生成了氢氧化铁沉淀和氢氧化铜沉淀;化学式分别为:Fe(OH)3、Cu(OH)2;
(3)加入盐酸发生了以下反应:MgO+2HCl═MgCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O、CuO+2HCl═CuCl2+H2O,溶液A的pH<1,说明反应后溶液呈强酸性,盐酸过量,因此溶液A中的阳离子有Mg2+、Fe3+、Cu2+、H+;
(4)溶液B与熟石灰反应的反应物是氯化镁和氢氧化钙,生成物是氢氧化镁沉淀和氯化钙,所以方程式是:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。

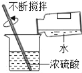
【题目】小君和小英同学发现:带火星的竹签在空气中不会复燃,若用装有60%水的集气瓶倒置在水槽中收集氧气,得到的气体能使带火星的竹签复燃,为了找到能使带火星竹签复燃的氧气含量最小值,他们进行了如下探究:
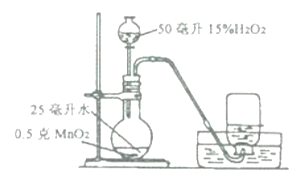
(设计实验)小君设计了如图的装置,该装置的圆底烧瓶中放入25毫升水的目的是____________。
(实验研究)第一组实验:取3只集气瓶,编号为①②③,分别装入15%30%和45%的水,盖上盖玻片倒置在水槽中。当气泡___________________放出后,导管口伸入集气瓶把其中的水全部排出,将相同的3支带火星竹签分别插入①~③号瓶中,记录实验现象。
获得第一组实验现象后,小君又做了第二组实验,并记录实验现象,两组实验数据和现象见下表:
实验分组 | 第一组 | 第二组 | ||||
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
集气瓶装水的体积分数/% | 15 | 30 | 45 | 34 | 38 | 42 |
带火星竹签状况 | 亮 | 很亮 | 复燃 | 很亮 | 复燃 | 复燃 |
得出上述两组实验现象后,小英认为还不能确定能使带火星竹签复燃的氧气含量最小值,需继续进行实验。则实验序号⑦的集气瓶装水的体积分数应该是_________%。
(实验结论)再经过数次实验并计算后得出:能使带火星竹签复燃的氧气含量最小值为48.7%。
(继续探究)小君认为采用该方法收集的氧气中含有一定量的水蒸气,请你提出实验改进的措施______________________。