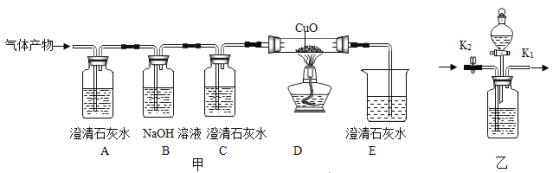
��Ŀ����
����Ŀ��ʵ����ij������Ʒ����������Ϊ�Ȼ��ƺ�һЩ���������ʣ���Ϊ�����Ȼ��ƺ���������ͼʵ�飬����ͼ��ͼ��
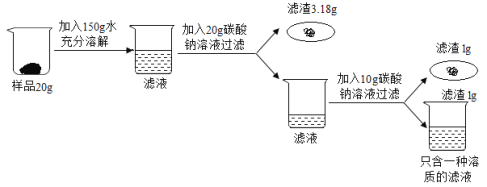
����ʵ�鼰������ݻش��������⣺
��1����д��ʵ������з�����Ӧ�Ļ�ѧ����ʽ_____��
��2��������֪����д���������10g̼������Һ��̼����������X���ı���ʽ_____��
��3���������Ȼ��Ƶĺ���Ϊ_____��
��4�������������ò�������Һ����4.18gˮ����������Һ�����ʵ���������Ϊ_____��
��5������ʵ������Һ�������õ��Ȼ��ƹ�������Ҫ�������д���Ȧ������̨���ƾ��ƣ�����Ҫ��������_____��
���𰸡�CaCl2+Na2CO3�TCaCO3��+2NaCl ![]() 77.45% 9.5% ������
77.45% 9.5% ������
��������
����ʵ�������ͼ��֪���ڵ�һ�ι���ʱ�ѽ��������ȥ���ڵڶ��μ���̼����ʱ�����˳�������Һ�е�����ֻ��һ�֣�˵����̼�������Ȼ���ǡ����ȫ��Ӧ��
��1���������֪��ʵ������з����ķ�Ӧ��̼�������Ȼ��Ʒ�Ӧ������̼��Ƴ������Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��2����ʵ�������ͼ��֪���ڵ�һ�ι���ʱ�ѽ��������ȥ���ڵڶ��μ���̼����ʱ�����˳�������Һ�е�����ֻ��һ�֣�˵����̼�������Ȼ���ǡ����ȫ��Ӧ��
��μӷ�Ӧ��̼���Ƶ�����Ϊx�����ɵ��Ȼ��Ƶ�����Ϊy���μӷ�Ӧ���Ȼ��Ƶ�����Ϊz
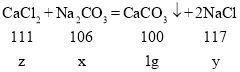
10g̼������Һ��̼����������x���ı���ʽ��![]() ����
����![]() ��
��
![]()
![]()
![]()
��3�����ʵ�����Ϊ![]() ��������Ʒ�Ȼ��Ƶ�������Ϊ��1.11g��3��3.33g
��������Ʒ�Ȼ��Ƶ�������Ϊ��1.11g��3��3.33g
�������Ȼ��Ƶĺ���Ϊ![]()
��4��������Һ�����ʵ���������Ϊ![]()
��5������ʵ������Һ�������õ��Ȼ��ƹ�������Ҫ�������д���Ȧ������̨���ƾ��ƣ�����Ҫ��������������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�