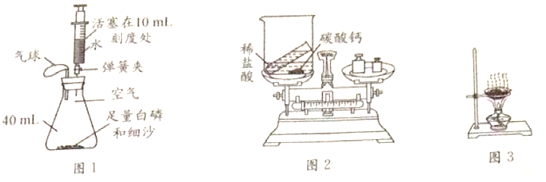
题目内容
【题目】碳酸亚铁(FeCO3)是生产补血剂的原料。以下是某同学设计的利用铁矿烧渣(主要成分为Fe2O3、FeO和泥沙等)制取碳酸亚铁的实验流程图:
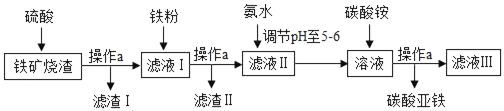
请回答下列问题:
(1)操作a中需要用到的玻璃仪器主要有烧杯、玻璃棒和_____。
(2)加入过量稀硫酸前要将铁矿烧渣粉碎的目的是_____滤液I中含有的溶质是:FeSO4、_____(填化学式)。
(3)滤液Ⅰ中加入铁粉后可能发生的化学方程式:
①Fe+Fe2(SO4)3=3FeSO4
②_____。
(4)加入碳酸铵得到碳酸亚铁的反应化学方程式:_____。
【答案】漏斗 使铁矿烧渣与硫酸充分反应,提高反应速率和转化率 H2SO4、Fe2(SO4)3 Fe+H2SO4=FeSO4+H2↑ FeSO4+(NH4)2CO3=FeCO3↓+(NH4)2SO4
【解析】
(1)操作a得到滤渣和滤液,所以是固体和液体分离的操作,为过滤;在实验室中该操作中需要用到的玻璃仪器主要有烧杯、玻璃棒和漏斗;
(2)由于反应物之间接触越充分,反应越快,转化率也越高,所以加入过量稀硫酸前要将铁矿烧渣粉碎的目的是 使铁矿烧渣与硫酸充分反应,提高反应速率和转化率。根据铁矿烧渣的主要成分为Fe2O3、FeO和泥沙等以及后期加入铁且后续操作加氨水调节pH至5到6,说明滤液Ⅰ中含有氧化铁和硫酸反应生成的硫酸铁以及氧化亚铁和硫酸反应所生成的硫酸亚铁和剩余的硫酸,所以滤液I中含有的溶质的化学式为:FeSO4、H2SO4、Fe2(SO4)3;
(3)根据滤液I中含有的溶质的化学式为:FeSO4、H2SO4、Fe2(SO4)3;可知滤液Ⅰ加入铁粉后由于对应生成物中都是亚铁,所以三价铁要转化为亚铁,同时剩余的硫酸也要转化为硫酸亚铁,所以可能发生的化学方程式:Fe+Fe2(SO4)3=3FeSO4和Fe+H2SO4=FeSO4+H2↑;
(4)加入碳酸铵得到碳酸亚铁是硫酸亚铁和碳酸铵反应生成碳酸亚铁和硫酸铵,根据后面过滤得到锑酸亚铁和滤液可知,此时碳酸亚铁应该是沉淀,所以对应的反应化学方程式:FeSO4+(NH4)2CO3=FeCO3↓+(NH4)2SO4。

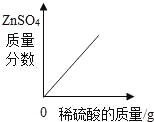
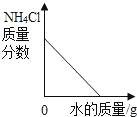
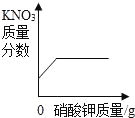
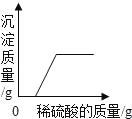
【题目】下列图象与所述实验相符的是( )
A | B | C | D |
向一定量锌粒中加入过量稀硫酸 | 向一定量氯化铵饱和溶液中不断加入水 | t℃时,向一定量不饱和的硝酸钾溶液中不断加入硝酸钾晶体 | 向一定量氢氧化钠和氢氧化钡的混合溶液中加入稀硫酸 |
|
|
|
|
A. AB. BC. CD. D