题目内容
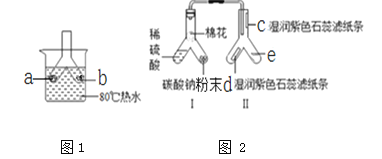
【题目】根据下列实验装置图,结合所学化学知识回答问题。
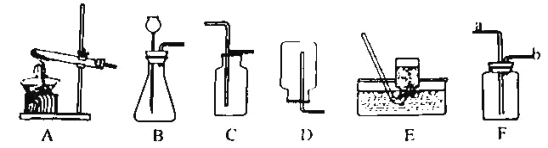
(1)加热时酒精灯_________焰温度最高
(2)实验室用氯酸钾和二氧化锰加热制取氧气,二氧化锰在反应前后的质量和_________都没有改变,根据氧气_________的物理性质可选择 E 装置收集氧气
(3)实验室可以选择发生装置_________(填字母)制取 CO2 气体,实验室制取该气体的 化学反应方程式是_________
(4)通常情况下,NH3 是一种无色、有刺激性气味的气体,极易溶于水且水溶液显碱性,密度比空气小。实验室里用氯化铵固体和氢氧化钙固体混合加热制取NH3。实验室制取NH3
应选择的发生装置是____________(填字母),若选择 F 装置利用排空气法收集 NH3,气体 应该从____口(填“a”或“b”)进入。将 NH3 溶于水中可配制成氨水溶液,氨 水能使无色酚酞变________色。
【答案】 外焰 化学性质 不易溶于水 B CaCO3+2HCl==CaCl2+H2O+CO2↑ A b 红
【解析】(1)酒精灯的外焰温度最高,加热时需要用酒精灯的外焰加热;
(2)实验室用氯酸钾和二氧化锰加热制取氧气,二氧化锰在反应前后的质量和化学性质都没有改变,根据氧气不易溶于水的物理性质可选择E装置收集氧气;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,适合于固+液常温型,故选B装置,碳酸钙和盐酸互相交换成分生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)需要用两种固体加热制取氨气,因此需要加热,故需要采用固固加热装置;知道氨气的密度比空气小,故采用F装置收集氨气的时候,要采用“短进长出”的方式,气体从b端进入;由题目可知,氨气溶于水后显碱性,所以氨气溶于水后滴加酚酞,依据酚酞遇碱变红色。

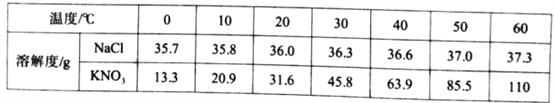
【题目】根据下表回答问题:
温度/℃ | 20 | 40 | 60 | |
溶解度 | NaCl | 36.0 | 36.6 | 37.3 |
| 31.6 | 63.9 | 110 | |
(1)60℃,100g水中最多能溶解![]() 的质量为__________。
的质量为__________。
(2)下列说法正确的是_________(填序号)。
A.20℃时,![]() 饱和溶液的质量分数为31.6%
饱和溶液的质量分数为31.6%
B.40℃时,136.6gNaCl溶液中一定含有36.6gNaCl
C.将40℃时![]() 的饱和溶液降温到20℃,析出32.3g
的饱和溶液降温到20℃,析出32.3g![]() 固体
固体
D.将40℃时NaCl和![]() 的饱和溶液分别降温至20℃,降温后两溶液质量分数的大小关系为NaCl>
的饱和溶液分别降温至20℃,降温后两溶液质量分数的大小关系为NaCl>![]()
(3)20℃时,按下列图示操作:

①在溶液A、B、C中,![]() 溶解达到饱和状态的有_______(填字母)。
溶解达到饱和状态的有_______(填字母)。
②比较溶液A、B中![]() 的质量分数:A_______B(填“>“或” <”或“=”)。
的质量分数:A_______B(填“>“或” <”或“=”)。
【题目】氧化铜能与多种物质反应,能否与氨气(NH3)反应呢?在老师的指导下,某同学进行了探究。(注:无水硫酸铜遇水变蓝)
(实验设计)按图设计组装好仪器,检查气密性,装入药品。
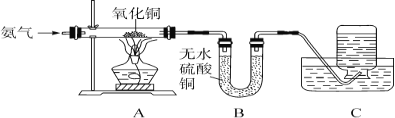
(进行实验)
(1)A中氧化铜全部转化成光亮的红色固体。
(2)B中U形管内物质变蓝。
(3)C中集气瓶内收集到一种无色气态单质,该气体用排水法收集的理由是___________________。
(4)从C中水槽里取适量液体于试管内,向试管里滴入无色酚酞溶液,溶液呈________色,原因是______________。
(实验结论)氧化铜和氨气发生反应,化学方程式是_______________________。
(继续探究)
(1)测得有关数据如下表:
质量 | 实验前 | 实验后 |
氧化铜粉末+玻璃管 | 65.6g | 59.2g |
在此反应中,参加反应的氧化铜的质量为________g。
(2)A中玻璃管内的反应证明,氨气的化学性质与____________(填物质化学式)有相似之处。