题目内容
【题目】小明同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡产生的速率有快有慢,于是他与小芳同学一起合作进行如下探究。
(提出问题)金属与酸反应的快慢受哪些因素影响呢?
(猜想与假设)猜想一:可能与酸的浓度有关;
猜想二:可能与金属的种类有关;
猜想三:可能与金属的形状有关。
(设计并进行实验 )为了验证猜想,小明和小芳设计下图所示装置进行实验。
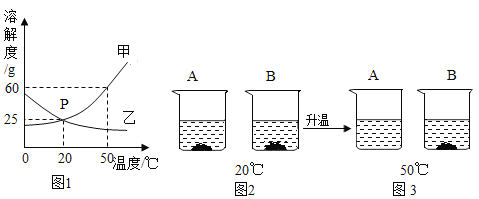
编号 | 盐酸的浓度(均取20 mL) | 金属(均取2g) | 金属的形状 | 收集50 mL氢气所需时间/s |
① | 10% | 铝 | 粉状 | 70 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 铝 | 片状 | 112 |
④ | 20% | 铁 | 片状 | 110 |

(1)小明和小芳检查图1装置气密性的方法是:关闭分液漏斗活塞,用力将注射器活塞向右移动一 段距离,停止用力后松手,若观察到_________________,则表示气密性良好。
(2)写出铝与盐酸反应的化学方程式:____________________________________。
(收集证据)
(3)要比较金属的形状对反应快慢的影响,应选择的实验编号是________________________。
(得出结论)
(4)通过上述四个实验,你得出的影响金属与酸反应的快慢因素有________________________。
(5)实验①中试管外壁发烫,说明铝与盐酸的反应是放热反应,实验测得该反应中产生气体的速率(v)与时间(t)的关系如图2所示,你认为在t2~t3时间段内反应速率逐渐减慢的主要原因是____________________。
(实验拓展)
(6)小明将盐酸换成稀硫酸继续进行实验,发现铝粉和稀硫酸的反应现象不明显。为什么铝粉易与盐酸反应而难与稀硫酸反应呢?小明认为可能是Cl-的存在使酸和铝的反应容易进行。请你帮助小明设计一个合理的实验来验证假设:___________。
【答案】活塞回到原位 ![]() ①③ 酸的浓度、金属的种类、金属的形状 由于铝与盐酸反应消耗了盐酸,盐酸的浓度变小,因此反应速率逐渐减慢 取两支试管,分别加入等质量相同的铝粉,然后分别加入等量的稀硫酸,在其中一支试管中加入一定量的氯化钠溶液,若观察到加入氯化钠溶液的试管中产生气泡的速率更快,说明Cl-的存在使酸和铝的反应更容易进行
①③ 酸的浓度、金属的种类、金属的形状 由于铝与盐酸反应消耗了盐酸,盐酸的浓度变小,因此反应速率逐渐减慢 取两支试管,分别加入等质量相同的铝粉,然后分别加入等量的稀硫酸,在其中一支试管中加入一定量的氯化钠溶液,若观察到加入氯化钠溶液的试管中产生气泡的速率更快,说明Cl-的存在使酸和铝的反应更容易进行
【解析】
(1)检查装置的气密性:关闭分液漏斗活塞,用力将注射器活塞向右移动一段距离,向右拉动活塞,如果装置不漏气,装置内压强减小,停止用力后松手,在外界大气压的作用下,将活塞左移至回到原处,故填:活塞回到原位;
(2)铝与盐酸反应生成氯化铝和氢气,该反应的化学方程式为:![]() ;
;
(3)要比较金属的形状对反应快慢的影响,除了金属的形状不同,金属的种类、盐酸的浓度都应相同,故应选①③;
得出结论:(4)由②④可知,盐酸的浓度越大,收集50 mL氢气所需时间越短,说明反应速率越快;由①③可知,铝为粉状时比铝为片状时,收集50 mL氢气所需时间短,说明金属的形状可以影响金属与酸反应的快慢;由②③可知,铝与盐酸反应生成50 mL氢气所需时间比铁短,说明金属种类可以影响金属与酸反应的快慢,故填:盐酸浓度、金属的种类、金属的形状;
(5)由以上分析可知,盐酸浓度会影响反应速率,铝与盐酸反应,消耗了盐酸,使盐酸浓度变小,故反应速率逐渐减慢,故填:由于铝与盐酸反应消耗了盐酸,盐酸的浓度变小,因此反应速率逐渐减慢;
实验拓展:该实验是验证Cl-的存在使酸和铝的反应容易进行,故可在铝与稀硫酸的反应中加入氯离子,看是否能加快反应速率,故可设计:取两支试管,分别加入等质量相同的铝粉,然后分别加入等量的稀硫酸,在其中一支试管中加入一定量的氯化钠溶液,若观察到加入氯化钠溶液的试管中产生气泡的速率更快,说明Cl-的存在使酸和铝的反应更容易进行。

【题目】下列实验设计能够达到对应实验目的的是
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
A | 验证质量守恒定律 |
| B | 证明二氧化碳气体的密度大于空气 |
|
C | 证明分子是不断运动的 |
| D | 探究铁钉锈蚀的条件 |
|
A.AB.BC.CD.D
【题目】如图为采用“数字化”实验,由传感器采集实验相关信息描绘出曲线,其中物质X表示能与二氧化碳反应的某溶液,纵坐标y表示烧杯中的某个量。下列对物质X与纵坐标y的分析正确的是

选项 | 物质X | 纵坐标y |
A | 水 | 溶液的质量 |
B | 水 | 溶液的pH |
C | 氢氧化钠溶液 | 溶质的质量 |
D | 氢氧化钙溶液 | 溶液中钙元素质量 |
A. AB. BC. CD. D
【题目】下列4个图像能正确反映对应变化关系是( )
A | B | C | D |
|
|
|
|
向一定量铁粉中滴加稀盐酸液 | 用酒精灯加热一定量KMnO4固体 | 向一定量澄清石灰水中加入Na2CO3溶液 | 向盛有MnO2的烧杯中加入H2O2溶液 |
A.AB.BC.CD.D