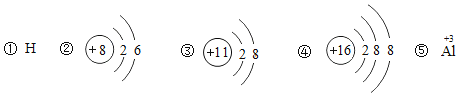题目内容
【题目】某探究小组的同学通过查阅资料得知:在加热条件下,镁不仅能与水反应还能与氯化铵溶液反应。小组同学对此产生兴趣,他们将砂纸打磨过的镁条加入氯化铵溶液中并加热,迅速产生大量气体。为确定生成气体的成分,他们进行如下探究:
(查阅资料)
(1)镁与氯化铵溶液反应生成两种气体,每种气体只含有氮、氢两种元素中的一种或两种。
(2)镁与水在加热条件下反应生成氢氧化镁和氢气。
(3)氨气是一种极易溶于水的气体,能与酸反应。
(提出问题)该气体成分是什么?
(做出猜想)猜想一:H2和N2
猜想二:N2和NH3
猜想三:_____
(进行实验)
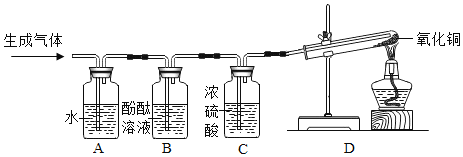
步骤一:小组同学闻气体气味,发现该气体有刺激性气味。则猜想_____不成立。
步骤二:同学们把产生的气体通入盛有水的A装置中除去_____,再将剩余气体依次通入B、C、D装置中,一会儿后,加热试管中的氧化铜,观察到B中溶液不变色,C中无明显现象,D中黑色粉末变成红色固体,试管口有小水珠。装置C的作用是_____(合理即可),装置D中发生反应的化学方程式为_____。
(得出结论)猜想_____成立。
(拓展延伸)经过讨论,小华同学认为用点燃木条检验气体的方法代替装置D也能达到相同的探究目的。你认为是否可行?_____(填“可行”或“不可行”)。
【答案】H2和NH3一氨气吸收生成气体中含有的水分H2+CuO![]() Cu+H2O三可行
Cu+H2O三可行
【解析】
[做出猜想]猜想三:由于镁与氯化铵溶液反应生成两种气体,每种气体只含有氮、氢两种元素中的一种或两种,镁与水在加热条件下反应生成氢氧化镁和氢气,故猜想是 H2和NH3。[进行实验]步骤一:H2和N2都无刺激性气味。步骤二:氨气极易溶于水,而H2和N2都难溶于水,所以把产生的气体通入盛有水的A装置中以除去NH3。浓硫酸具有吸水性,能除去气体中的水蒸气。D中黑色粉末变成红色固体,试管口有小水珠,则是氧化铜变为铜,同时有水生成,发生的反应是:H2+CuO![]() Cu+H2O。[得出结论]由装置D中的实验现象可知,生成的气体中含有氢气,则猜想三成立。[拓展延伸]氢气具有可燃性,氮气不具有可燃性,所以用点燃木条检验气体的方法代替装置D也能达到相同的探究目的。
Cu+H2O。[得出结论]由装置D中的实验现象可知,生成的气体中含有氢气,则猜想三成立。[拓展延伸]氢气具有可燃性,氮气不具有可燃性,所以用点燃木条检验气体的方法代替装置D也能达到相同的探究目的。

【题目】下表是元素周期表的部分信息,请根据下表回答有关问题:
3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)具有相似化学性质的一组元素是__________。(用2B铅笔将答题卡上对应题目的答案标号涂黑)
A.Na、Cl B.C、Be C.F、Cl D.Cl、Ar
(2)由第7号元素和第12号元素的原子形成化合物的化学式为__________。
(3)某粒子的结构示意图为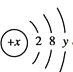 ,当
,当![]() 时,该粒子的符号为__________。
时,该粒子的符号为__________。
(4)钠、氯、氧三种元素可形成原子个数比为1:1:4的化合物,则此化合物中氯元素的化合价为__________。
(5)具有相同原子数和电子数的分子或离子叫等电子体。下列各组粒子中属于等电子体的是__________。(用2B铅笔将答题卡上对应题目的答案标号涂黑)
A.NO和O3 B.CO和N2 C.SO2和CO2 D.NH4+和H20+
【题目】现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
求:
(1)该混合物粉末中铜的质量分数 ________ ;
(2)若参加反应的金属为R,请写出R与稀硫酸反应的化学方程式 ________ ;
(3)设金属R的相对原子质量为X,根据已知条件列出求解(X)的比例式 ________ ;
(4)如果将第三次加入硫酸充分反应后的溶液蒸发掉8.3g水,且无晶体析出,则所得溶液中溶质的质量分数为________ .