题目内容
【题目】下表是元素周期表的部分信息,请根据下表回答有关问题:
3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)具有相似化学性质的一组元素是__________。(用2B铅笔将答题卡上对应题目的答案标号涂黑)
A.Na、Cl B.C、Be C.F、Cl D.Cl、Ar
(2)由第7号元素和第12号元素的原子形成化合物的化学式为__________。
(3)某粒子的结构示意图为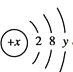 ,当
,当![]() 时,该粒子的符号为__________。
时,该粒子的符号为__________。
(4)钠、氯、氧三种元素可形成原子个数比为1:1:4的化合物,则此化合物中氯元素的化合价为__________。
(5)具有相同原子数和电子数的分子或离子叫等电子体。下列各组粒子中属于等电子体的是__________。(用2B铅笔将答题卡上对应题目的答案标号涂黑)
A.NO和O3 B.CO和N2 C.SO2和CO2 D.NH4+和H20+
【答案】CMg3N2S2-+7B
【解析】
(1)元素的化学性质与其原子的最外层电子数有关,故化学性质相似的元素在同一族,选择C;
(2)由元素周期表可知,第7号元素是氮元素,为非金属元素,第12号元素是镁元素,为金属元素,书写化学式时,金属元素在前,非金属元素在后,镁元素形成化合物时化合价为+2,氮元素与金属元素化合时显负价,为-3,根据元素正负化合价代数和为零,化学式为Mg3N2
(3)若该粒子为原子,则有x=2+8+y,可知x-y=10,与题目要求![]() 不符,故该粒子为离子,且得到两个电子达到相对稳定结构,y=8,x=16,故该粒子符号为S2-。
不符,故该粒子为离子,且得到两个电子达到相对稳定结构,y=8,x=16,故该粒子符号为S2-。
(4)钠、氯、氧三种元素可形成原子个数比为1:1:4的化合物,则化学式为NaClO4,钠元素为+1,氧元素为+2,假设氯元素化合价为a,根据元素正负化合价代数和为零,有(+1)×1+a×1+(-2)×4=0,解得a=+7,故此化合物中氯元素的化合价为+7。
(5)A、NO质子数为7+8=15,O3质子数为8×3=24,故不是等离子体;B、CO质子数为6+8=14,N2的质子数为7×2=14,故为等离子体;C、SO2的质子数为16+8×2=32,CO2的质子数为6+8×2=22,故不属于等离子体;D、NH4+的电子数为10,H20+的电子数为9,不属于等离子体。故本题选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
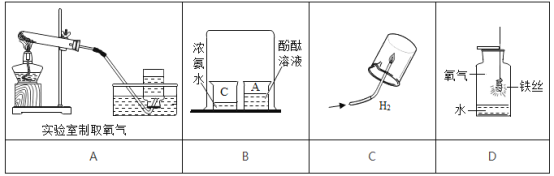
小学生10分钟应用题系列答案【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
查阅资料
a.固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
b.氯化钙、氯化溶液均呈中性。
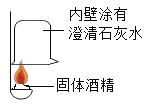
(提出问题)
①酒精中是否含有碳元素?
②固体酒精中的氢氧化钠是否变质?
(实验探究)
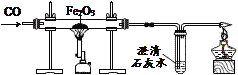
①按右图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精中含有碳元素的结论,理由是_______________。
②取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的:_______________由此说明氢氧化钠已变质。
③为进一步确定氢氧化钠的变质程度,分组进行探究。
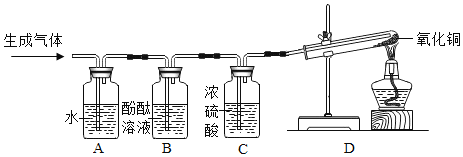
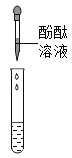
甲组同学取烧杯上层清液于两支试管中,按下图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生______________ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_______________
他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)乙组实验中加足量氯化钡溶液的目的是_____________
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。