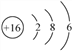题目内容
【题目】金属材料在人类的生产、生活中有着十分重要的作用。
(1)铝是一种常见金属,用途十分广泛。请回答下列问题:
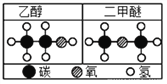
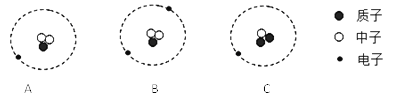
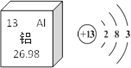
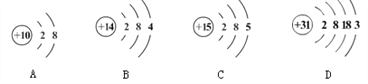
①下图是铝在元素周期表中的信息以及原子结构示意图。铝的相对原子质量是________,下列原子结构示意图所对应的元素与铝元素化学性质相似的是________(填字母序号,下同)。
②氮化铝(AlN)是一种良好的耐热冲击材料,氮化铝中N元素的化合价为_________价;氮化铝遇水缓慢反应产生一种白色胶状沉淀氢氧化铝和一种刺激性气味的气体(该气体通入无色酚酞试液后,试液变红),则该反应的化学方程式为_________。
③铝块能制成铝箔、铝丝,是利用了铝的_________________性;铝制品不易锈蚀的原因是___________________(用化学方程式解释)。
④为探究铝、铜的金属活动性顺序,某同学选用了下列药品进行实验,其中可行的是__________。
a.铝丝、铜丝、氯化镁溶液 b.铝丝、铜丝、硫酸铜溶液
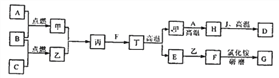
(2)A~G是初中化学常见的物质。已知A为黑色固体单质,B为红棕色粉末,G为紫红色固体单质,它们的转化关系如右图所示,回答问题。

①写出化学式:B__________;E_________。
②反应Ⅲ的化学方程式为_____________________。
(3)用200t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量为_______t(结果保留至0.1)。
【答案】 26. 98 D -3 AlN + 3H2O = Al(OH)3↓ + NH3↑ 延展 4Al + 3O2 = 2Al2O3 b Fe2O3 CO Fe + CuSO4 = FeSO4 + Cu 116.7
【解析】(1) ①由图中元素周期表可以获得的信息,汉字下面的数字表示相对原子质量,铝的相对原子质量为26.98;原子最外层电子数相同,化学性质相似,图乙中的四种粒子的化学性质与铝原子相似的是D;②Al元素的化合价为+3价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+3)+x=0,则x=3价;氮化铝可与水反应生成氢氧化铝和氨气(NH3),反应的方程式是:AlN+3H2O=Al(OH)3↓+NH3↑;③铝块能制成铝箔、铝丝是利用了铝的延展性,铝制品不易锈蚀的原因是铝在空气中氧化生成一层致密的氧化铝薄膜覆盖在铝的表面阻止铝进一步氧化:4Al + 3O2 = 2Al2O3;④a、铝丝、铜丝都不与氯化镁溶液反应,不能验证两种金属的活动性;b、铝丝和硫酸铜溶液反应,证明铝的活动性比铜强;(2)A为黑色固体单质,而B为红棕色粉末,所以可以判断A为碳单质,而B为氧化铁粉末,它们在高温的条件下反应生成铁和二氧化碳,而C为无色气体,则C为二氧化碳,D为铁,C可以和A在高温下反应,则E为一氧化碳,G为紫红色固体单质,则G为单质铜,一氧化碳和F在加热条件下反应生成G单质铜,则F为氧化铜;①根据上述分析可知B为Fe2O3,B为CO;②反应Ⅲ是铁和硫酸铜反应生成铜和硫酸亚铁,反应的方程式为:Fe+CuSO4=FeSO4+Cu;(3)设理论上可以炼出含铁96%的生铁的质量是![]() ,
,
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160 112
![]()
![]()
![]()
![]() ≈116.7t。
≈116.7t。

【题目】(1)下列实验现象的描述正确的是(______)(多选,用字母作答)
A. 将燃烧的木条伸入人体呼出的气体中,木条燃烧更旺
B.一氧化碳在空气中燃烧,产生蓝色火焰
C.将一根打磨过的铁丝伸入硫酸铜溶液中,铁丝表面有红色固体析出
D. 向滴有酚酞的NaOH溶液中逐滴滴加稀盐酸,溶液由无色变为红色
E. 将一枚生锈的铁钉浸入稀盐酸中片刻,溶液变为浅绿色
(2)请从下列甲乙两题中任选一题作答。
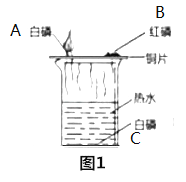
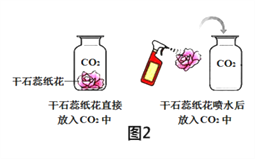
试题甲:探究燃烧的条件 | 试题乙:探究二氧化碳的性质 |
|
|
实验过程,能观察到燃烧现象的是 _____,(填序号),热水的作用是 _____和隔绝氧气,实验方法为控制变量法,就白磷而言,控制的变量为____。 | 实验过程中观察到,干石蕊纸花喷水后放入二氧化碳中,纸花的颜色会____ ,反应的化学方程式为____,实验方法为控制变量法,本实验控制的变量为 ______。 |