题目内容
【题目】按照如图的生产流程可以制得氧化铁(铁红颜料)和硫酸钾。

(1)写出铁与氧两种元素所形成化合物的化学式______、______、______。
(2)沉淀池甲中反应后生成碳酸亚铁、硫酸铵、水和一种温室气体,写出该反应的化学方程式_______________________。
(3)该流程中加硫酸酸化的目的______________________。
(4)在沉淀池乙中还要加入有机溶剂丙醇,其原因可育提_____________________。
(5)滤液X中含有KCl和(NH4)2SO4,在农业上的用途是_____________________。
【答案】 Fe2O3 FeO Fe3O4 FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑ 是为了除去过多的NH4HCO3 K2SO4易溶于水,难溶于有机溶剂丙醇 可作复合肥料
【解析】由题中信息知,(1)铁与氧两种元素所形成化合物的化学式是Fe2O3 . FeO . Fe3O4 。(2)沉淀池甲中反应后生成碳酸亚铁、硫酸铵、水和一种温室气体,该反应的化学方程式是FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+H2O+CO2↑。(3)该流程中加硫酸酸化的目的 是为了除去过多的NH4HCO3。(4)在沉淀池乙中还要加入有机溶剂丙醇,其原是K2SO4易溶于水,难溶于有机溶剂丙醇。 (5)滤液X中含有KCl和(NH4)2SO4,在农业上的用途是可作复合肥料。
点睛∶本题主要考查与制备氧化铁(铁红颜料)和硫酸钾实验相关的知识。

【题目】(1)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:
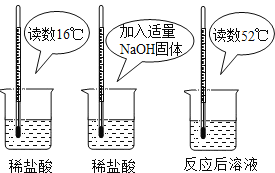
根据如图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应.乙同学认为:甲同学得出这个结论的依据不科学,理由是_____________________________。丙同学认为:通过多个实验才能得出一个普遍的结论。请你再举出一个酸碱中和反应的实例,写出反应的化学方程式_____________________________。
(2)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5g溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g20%的氢氧化钠溶液,最后测量其温度,数据记录如下:
烧杯编号 | A | B | C | D | E |
盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
【实验结论】影响中和反应放出热量多少的因素是____________________________。
【交流反思】反应后,烧杯内溶液pH最小的是______(填烧杯编号)。
若要使40g20%的氢氧化钠溶液恰好完全中和,则需要10%的盐酸溶液多少克?(根据化学方程式列式计算)__________
