题目内容
【题目】高速铁路可以加快出行步伐。结合所学化学知识,回答下列问题:
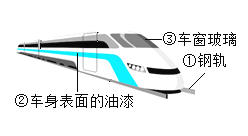
①图中标示的物质中为金属材料的是_____(填序号),动车表面喷漆主要是为了防止外壳生锈,其原理是_____。
②修建铁路所需的大量钢铁是以铁矿石为主要原料冶炼而得。下列矿石的主要成分属于氧化物的是_____(填字母序号)。
A.铝土矿(主要成分A12O3) B.辉铜矿(主要成分Cu2S)
C.菱铁矿(主要成分FeCO3) D.磁铁矿(主要成分Fe3O4)
【答案】① 隔绝氧气和水 AD
【解析】
①图中标示的物质中为金属材料的是钢轨,铁制品与氧气和水同时接触易生锈,故动车表面喷漆可以防止外壳生锈,其原理是隔绝氧气和水。
②氧化铝和四氧化三铁都是由氧元素和另外一种元素组成的化合物,都是氧化物。

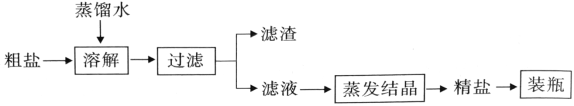
【题目】如表为元素周期表的一部分,请利用数字①﹣⑤所表示元素完成下列问题。
① | He | ||||||
② | ③ | Ne | |||||
④ | ⑤ | Ar | |||||
(1)写出一种酸的化学式_____;
(2)由①、③两种元素组成,且元素③呈﹣1价的物质的化学式为_____;
(3)用化学用语表示:一种不溶性碱中金属元素的化合价_____;
(4)由①、③、④三种元素组成的物质能使紫色石蕊试液变为_____(填颜色)。
【题目】某研究性学习小组将铁粉投入盛有硫酸铜溶液的试管中,发现生成红色固体物质的同时有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体?
(提出猜想)从物质组成元素的角度,放出的气体可能是SO2、O2、H2。
(查阅资料)SO2易溶于水,能与NaOH反应,生成Na2SO3。
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是_____。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。
(3)实验小组同学合作设计了如图1实验方案,对提出的猜想进行验证。

①如果放出的是O2和H2,你认为方案中的安全隐患是_____。
②丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指堵住试管口,_____,若不发出尖锐的爆鸣声,方可采用上面的装置进行实验。
(实验探究)经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
(实验结论)铁粉与硫酸铜溶液反应时,产生的气体是_____。
(思维拓展)
(4)由上述实验可以推出,硫酸铜溶液中可能含有_____物质(填酸性、中性或碱性)。
(5)写出装置B中所发生反应的方程式
(6)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?
丁同学设计了如图2所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是_____。
(定量探究)该研究性学习小组的同学在教师的指导下,设计如下实验方案对硫酸铜溶液进行定量探究。
A.量取100mL上述硫酸铜溶液,倒入放在电子天平上的烧杯中,然后加入20.00g铁粉,充分搅拌,有关实验数据记录如下:
称量项目 | 称量时间 | 质量/g |
烧杯 | 55.65 | |
烧杯+硫酸铜溶液 | 215.65 | |
烧杯+硫酸铜溶液+铁粉 | 30s | 235.59 |
烧杯+硫酸铜溶液+铁粉 | 60s | 235.45 |
烧杯+硫酸铜溶液+铁粉 | 90s | 235.45 |
B.90s后,将烧杯中的物质经“过滤,洗涤、干燥、称量”,得滤渣15.2g。
C.取少量滤渣于试管中,加入稀硫酸,观察到有气泡产生。
(7)请根据实验现象和有关数据,回答下列问题:
①加入铁粉后,用玻璃棒不断搅拌的原因是_____。
②计算上述硫酸铜溶液中CuSO4的质量分数_____。(写出计算过程。)