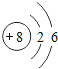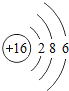题目内容
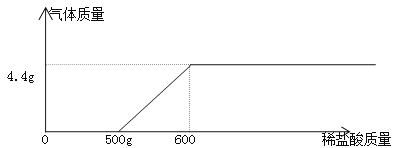
【题目】现有NaOH、NaCl和Na2CO3固体混合物109.1g。在烧杯中加入水溶解,向烧杯中加入稀盐酸,加入稀盐酸的质量与产生气体的关系如图:
求:
(1) 完全反应后,产生二氧化碳气体的体积是多少L?,保留一位小数。(已知二氧化碳气体密度为1.9g/L)
⑵加入稀盐酸的的质量分数?
⑶计算原混合物中NaCl的质量分数,保留一位小数。
【答案】(1)2.3L;(2)7.3%;⑶53.6%
【解析】
NaOH、NaCl和Na2CO3固体混合物中的Na2CO3固体能与稀盐酸反应生成二氧化碳气体,根据图像可知,与Na2CO3固体反应的稀盐酸的质量为:600g-500g=100g。(1)因为ρ=![]() ,所以v=
,所以v=![]() =
=![]() =2.3L。
=2.3L。
⑵设加入稀盐酸的的质量分数为x,则100g稀盐酸所含溶质的质量为:100g×x
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
73 44
100g×x 4.4g
![]() =
=![]() ,解得x=7.3%
,解得x=7.3%
⑶根据图像可知,与NaOH反应的稀盐酸的质量为500g,500g稀盐酸中所含溶质的质量为:500g×7.3%=36.5g
设固体混合物中NaOH的质量为y
NaOH + HCl == NaCl + H2O
40 36.5
y 36.5g
![]() =
=![]() ,解得y=40g
,解得y=40g
设固体混合物中Na2CO3的质量为z
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
106 44
z 4.4g
![]() =
=![]() ,解得z=10.6g
,解得z=10.6g
原混合物中NaCl的质量为:109.1g-10.6g-40g=58.5g
则原混合物中NaCl的质量分数为:![]() ×100%=53.6%
×100%=53.6%

【题目】化学式在分子、原子水平上研究物质的组成、结构、性质及其应用的一门基础自然科学.
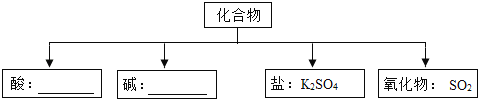
(1)现有H、O、S、K四种元素,从中选择合适的元素,根据下面物质分类的要求,组成相应类别物质的化学式,填在如图所示的横线上.
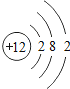
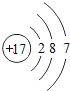
(2)下表列出了部分元素的原子结构示意图.请回答下列问题:
O | Mg | S | Cl |
|
|
|
|
氧原子的核电荷数为 ,硫原子在化学反应中易 (填“得到”或“失去”)电子,由镁元素和氯元素组成化合物的化学式为 ,氧元素和硫元素化学性质具有相似性的原因是它们的原子 相同.