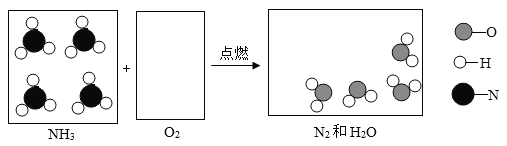
题目内容
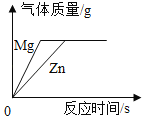
【题目】化学小组同学设计实验,用红磷燃烧、蜡烛燃烧测定空气中氧气含量,比较其实验结果的差别。实验时将红磷、蜡烛点燃后,同时伸入到大小相同的两个集气瓶中。
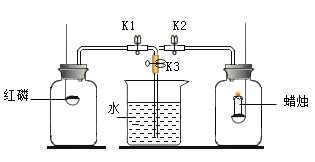
(已知:实验前K1、K2、K3均关闭)
(1)红磷燃烧的化学反应方程式为_____。
(2)待反应完毕,装置冷却到室温后,应进行的操作是:先打开K1、K3,一段时间后,再_____。
(3)若某同学实验时,先将K1、K2打开,再将点燃的红磷、蜡烛同时伸入两个集气瓶中,待反应完毕,装置冷却到室温后,打开止水夹K3,观察到的现象是_____。
【答案】4P+5O2 2P2O5 关闭K1、打开K2 烧杯中的水流入两个集气瓶中且水量相同
2P2O5 关闭K1、打开K2 烧杯中的水流入两个集气瓶中且水量相同
【解析】
(1)红磷燃烧生成五氧化二磷,化学反应方程式为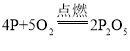 。
。
(2)待反应完毕,装置冷却到室温后,应进行的操作是:先打开K1、K3,使烧杯的水倒流进入左广口瓶,一段时间后,再关闭K1、打开K2,观察水进入右广口瓶的情况。
(3)若某同学实验时,先将K1、K2打开,再将点燃的红磷、蜡烛同时伸入两个集气瓶中,待反应完毕,装置冷却到室温后,打开止水夹K3,有与整个装置形成连通,气压相同,观察到的现象是烧杯中的水流入两个集气瓶中且水量相同。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
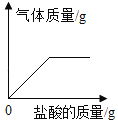
名题金卷系列答案【题目】某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加入样品的质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.54 | 3.08 | 4.5 | m |
(1)上表中m的数值是_____
(2)试计算这种石灰石矿中碳酸钙的质量分数____。
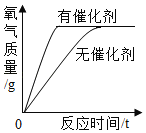
【题目】做完“铁在氧气里燃烧”实验后,小明同学有两个疑惑不解的问题,于是他进行了以下探究活动,请你一同参与.
(问题)铁燃烧时溅落下来的黑色物质中还有没有铁呢?
(查阅资料)(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3)
(2)铁的氧化物均能溶于酸的溶液.
(实验探究)将冷却后的黑色物质碾碎,装入试管,加入 ______ 溶液,观察到的现象是 ______,说明铁燃烧时溅落下来的黑色物质中还含有铁.
(问题)铁燃烧的产物为什么不是 Fe2O3呢?
(查阅资料)
(1)Fe3O4和Fe2O3分解温度、铁的熔点见表:
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 |
|
熔点/℃ |
|
| 1535 |
(2)Fe2O3高温时分解成Fe3O4
(理论探讨)根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在 ______ 之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
(拓展研究)
(1)实验中为了防止集气瓶炸裂,必须 ______.
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式 ______.
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色______,就说明包装盒破损进气,这样售货员就能及时发现并处理.
【题目】长郡双语实验中学化学兴趣小组的同学将氢氧化钠溶液和稀硫酸混合,没有观察到明显的现象,他们对此提出了如下问题并进行了相应探究:
问题一:二者之间是否发生了反应?他们设计了如下方案证明二者之间确实发生了反应:
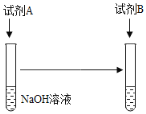
(1)可以选择的试剂组合有____________(填序号)。
①试剂A:足量稀硫酸,试剂B:MgCl2溶液
②试剂A:足量稀硫酸,试剂B:铁粉
③试剂A:少量稀硫酸,试剂B:MgCl2溶液
④试剂A:少量稀硫酸,试剂B:铁粉
(2)小玮认为:若选用_________溶液,不管加入顺序如何,只需控制加入稀硫酸的量也能证明二者发生了反应。
问题二:反应后溶液中溶质有哪些?
(猜想假设)猜想一:只有Na2SO4;猜想二:Na2SO4和NaOH;猜想三:Na2SO4和H2SO4。
(查阅资料)①Na2SO4溶液显中性,②Na2SO4+BaCl2=BaSO4↓+2NaCl。
(实验操作)分别取少量反应后的溶液于试管中,进行如下实验:
实验编号 | 实验过程 | 实验现象 |
① | 加入酚酞溶液 | 不变红 |
② | 加入少量BaCl2溶液 | 产生白色沉淀 |
③ | 加入少量(3)______溶液 | 没有气泡产生 |
(实验结论)猜想一成立。
(实验反思)小光认为,实验(4)________(填实验编号)可省略。小娟取少量反应后的溶液中于试管中,加入红色固体(5)___________(填化学式),观察到红色固体不溶解,也得出了相同结论。