题目内容
SO2是形成酸雨的主要污染物,目前有一种较为有效的方法是在高空喷洒一种粉末状物质X,脱硫效果可达85%,其反应的化学方程式为2X+2SO2+O2═2CaSO4+2CO2,由此可知X化学式是( )A.CaO
B.CaCO3
C.Ca(OH)2
D.CaS
【答案】分析:在化学反应中,反应前后元素和原子的种类不变,原子的个数和种类不变.
解答:解:根据质量守恒定律可知,X中有一个钙原子、一个碳原子和三个氧原子,X的化学式为:碳酸钙.
故选B
点评:本题主要考查了如何根据化学方程式来判断物质的化学式方面的问题.
解答:解:根据质量守恒定律可知,X中有一个钙原子、一个碳原子和三个氧原子,X的化学式为:碳酸钙.
故选B
点评:本题主要考查了如何根据化学方程式来判断物质的化学式方面的问题.

练习册系列答案
相关题目
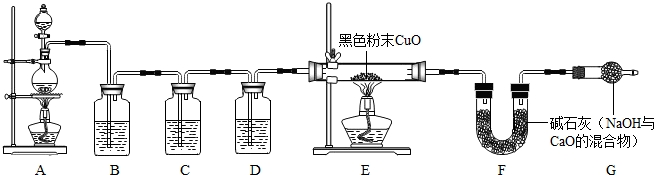
 ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
 浓ZnSO4+SO2↑+2H2O计算后.取一定量的锌粉与98%的浓硫酸恰好完全反应.
浓ZnSO4+SO2↑+2H2O计算后.取一定量的锌粉与98%的浓硫酸恰好完全反应.
 浓ZnSO4+SO2↑+2H2O计算后.取一定量的锌粉与98%的浓硫酸恰好完全反应.
浓ZnSO4+SO2↑+2H2O计算后.取一定量的锌粉与98%的浓硫酸恰好完全反应.
 ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。