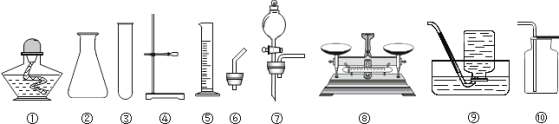
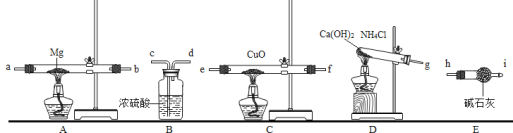
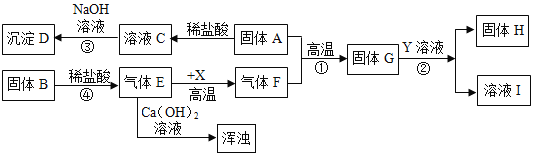
题目内容
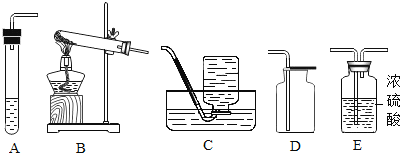
【题目】实验室常用如图所示的装置制取气体和气体性质的验证,请回答:
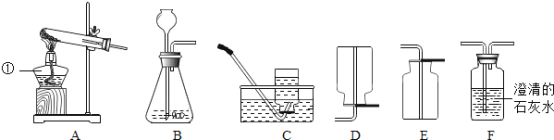
(1)仪器①的名称________.
(2)图示装置中有明显错误的装置是________(填序号),以下用改正后的装置实验。
(3)某同学利用石灰石和盐酸通过装置B、F来验证二氧化碳的性质,请写出B中发生反应的方程式_____________实验过程中观察到F中有气泡冒出,澄清的石灰水未变浑浊,试分析其可能的原因________.若检验该杂质应在F中换装_______溶液,写出相关反应方程式____________________.
(4)实验室常用无水醋酸钠和碱石灰的混合固体在加热条件下制取甲烷气体,发生装置可选择______(填序号).甲烷气体一般采用装置C进行收集,收集满后集气瓶的放置方式如图所示,据此可推断甲烷一定具备的物理性质是:___________、___________.
【答案】酒精灯 A CaCO3+2HCl═CaCl2+H2O+CO2↑ 盐酸浓度过大挥发出氯化氢气体 硝酸银 HCl+AgNO3=AgCl↓+HNO3 A 甲烷的密度比空气小 甲烷不溶于水
【解析】
(1)仪器①是酒精灯;故填:酒精灯;
(2)装置A中伸入试管内的导管太长,不利于气体的导出;故填:A;
(3)石灰石的主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;若二氧化碳气体不能使石灰水变浑浊,可能是盐酸浓度过大挥发出氯化氢气体,与氢氧化钙发生了反应,检验氯化氢气体常用硝酸银溶液,氯化氢溶于水形成盐酸,盐酸与硝酸银反应生成氯化银白色沉淀和硝酸;故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;盐酸浓度过大挥发出氯化氢气体;硝酸银;HCl+AgNO3=AgCl↓+HNO3;
(4)用无水醋酸钠和碱石灰的混合固体在加热条件下制取甲烷气体,属于加热固体型,故选发生装置A;甲烷可用排水法收集,说明甲烷的物理性质是不溶于水,集气瓶倒放,说明其密度比空气小;故填:A;甲烷的密度比空气小;甲烷不溶于水。

【题目】向烧杯中逐滴加入X溶液至过量(图甲),生成沉淀或气体的质量(纵坐标)与加入X溶液的质量(横坐标)关系不符合图乙的是( )

烧杯中的物质 | X溶液 | |
A | 稀硫酸和稀盐酸 | 氯化钡溶液 |
B | 稀硫酸和硫酸铜溶液 | 氢氧化钠溶液 |
C | 澄清石灰水 | 碳酸钠溶液 |
D | 碳酸氢钠溶液 | 稀盐酸 |
A.AB.BC.CD.D
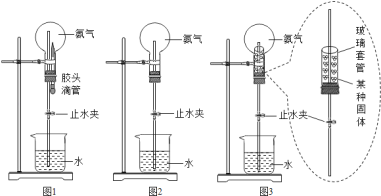
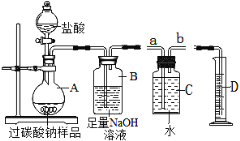
【题目】某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如上图,请你帮助他完成相关内容.
制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
二氧化碳(干燥) | 大理石和稀盐酸 | _________ | ________ |
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是_________(填序号).
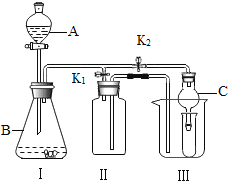
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是_______________。
【题目】碱式碳酸镁高温能分解,可用于镁盐制备,制药工业等。其组成一般以xMgCO3·yMg(OH)2·zH2O表示。
Ⅰ.研究其分解产物
(1)取样高温灼烧,检测到有二氧化碳和水生成,充分反应后,得到白色固体,由此推断生成物中肯定不含金属镁及单质碳,理由是 。
(2)检验生成物中是否含有碳酸镁、氢氧化镁。
操作现象 | 结论 | |
① | 取适量生成物置于试管中, 。 | 生成物中不含碳酸镁。 |
② | 取适量生成物置于试管中,加入热水,滴入酚酞试液, 观察到 现象。 | 生成物中不含氢氧化镁。 |
;(3)用酚酞试液检验是否存在氢氧化镁不能用冷水代替热水是因为 。综合上述实验推断碱式碳酸镁的分解产物为二氧化碳、水和 。
Ⅱ.测定碱式碳酸镁中碳元素的质量分数
按下图一进行实验。
①量气管中装有饱和碳酸氢钠溶液,不能用水代替是因为 ,若用稀盐酸代替稀硫酸,则测出碳元素的质量分数将 (填“偏大”、“偏小”或“无影响”)。
②实验中共消耗稀硫酸20mL,根据所测数据求得生成气体的质量为1.32g,则进入量气管的气体体积为 ,碳元素的质量分数为 。(实验条件下CO2密度为1.97g/L)

Ⅲ.确定碱式碳酸镁的组成
设计如上图二装置,并按下述步骤操作。
步骤1:检查装置的气密性,将36.4g样品置于试管中,称量装置B的质量为192g。
步骤2:加热装置A直至样品完全反应。
步骤3:用止水夹夹紧装置A和装置B间胶皮管,停止加热,冷却至室温。
步骤4:称量装置B的质量为199.2g。
(1)装置B中物质为 ,装置C的作用为 。判断样品完全反应的方法:当观察到装置B中 ,则样品已完全反应。
(2)根据上述实验数据求出碱式碳酸镁的化学式,写出计算过程。 (3分)
Ⅵ.有人说“加热碱式碳酸镁最后阶段固体质量减少是因为生成二氧化碳”是真的吗?
另取一定量碱式碳酸镁样品在空气中加热,测出样品的固体残留率(![]() ×100%)随温度的变化如图所示,请回答下列问题。
×100%)随温度的变化如图所示,请回答下列问题。

①0至t1℃过程中固体质量保持不变的原因是 。
②分析图像数据判定该说法是 (填“真的”或“假的”),判定理由是 。