题目内容
【题目】请根据下图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:
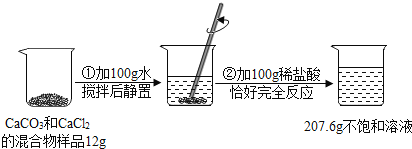
(1)实验所用稀盐酸的溶质的质量分数为 7.3%.
(2)计算原混合物样品中CaCl2的质量(写出计算过程).
【答案】7.3%;2g
【解析】
试题分析:依据质量守恒定律化学反应前后物质的总质量不变,那么减少的质量为生成的二氧化碳的质量;再利用化学方程式,根据二氧化碳的质量可求出盐酸中溶质的质量和参加反应的碳酸钙的质量;
解:(1)生成二氧化碳的质量为:100g+12g+100g—207.6g=4.4g
设参加反应的盐酸质量为x,碳酸钙的质量为y,则:
CaCO3+2HCl=CaCl2+CO2↑+H2O
1007344
yx4.4g
73/x=44/4.4g
x=7.3g
7.3g/100g×100%=7.3%
(2)100/y=44/4.4g
y=10g
12g—10g=2g
答:所用盐酸的质量分数为7.3%,原混合物中的CaCl2的质量为2g

【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | CaO | CaCO3 | 加水溶解、过滤、蒸发 |
B | CO2 | CO | 点燃 |
C | FeCl2溶液 | CuCl2 | 加入过量铁粉,充分反应后过滤 |
D | NaCl溶液 | Na2CO3 | 加入适量的硝酸钙溶液,充分反应后过滤 |
A. A B. B C. C D. D
【题目】某矿石由MgO、Fe2O3、CuO、SiO2组成,先将矿石粉碎,再用它制备氢氧化镁,流程示意图如图所示:
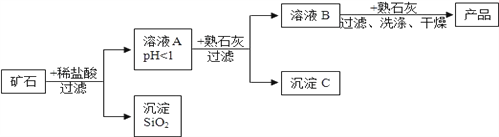
(1)矿石粉碎的目的是______________________________。
(2)上述工艺流程中多处涉及“过滤”,该操作需要的玻璃仪器有烧杯、漏斗和_______。
(3)写出得到溶液A的一个化学方程式______________________________________。
(4)求出沉淀SiO2中Si的化合价为______。
(5)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为___________________________________,
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
溶液B中一定含有的溶质为_________________。