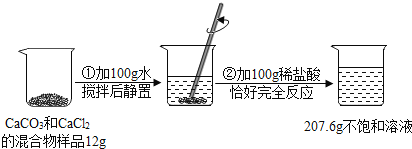
题目内容
【题目】某矿石由MgO、Fe2O3、CuO、SiO2组成,先将矿石粉碎,再用它制备氢氧化镁,流程示意图如图所示:
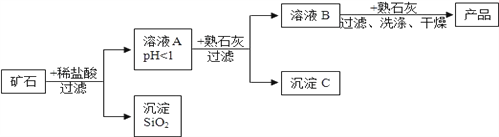
(1)矿石粉碎的目的是______________________________。
(2)上述工艺流程中多处涉及“过滤”,该操作需要的玻璃仪器有烧杯、漏斗和_______。
(3)写出得到溶液A的一个化学方程式______________________________________。
(4)求出沉淀SiO2中Si的化合价为______。
(5)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为___________________________________,
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
溶液B中一定含有的溶质为_________________。
【答案】 增大接触面积,加快反应速率 玻璃棒 MgO+2HCl=MgCl2+H2O或Fe2O3+6HCl═2FeCl3+3H2O或CuO+2HCl=CuCl2+H2O +4 6.7- 8.6 MgCl2、CaCl2
【解析】(1)矿石粉碎的目的是增大接触面积,加快反应速率;
(2)过滤时用到的玻璃仪器有烧杯、漏斗、玻璃棒;玻璃棒起到引流的作用;
(3)氧化镁和稀盐酸反应生成氯化镁和水,氧化铁和稀盐酸反应生成氯化铁和水,氧化铜和稀盐酸反应生成氯化铜和水,反应的化学方程式为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl═2FeCl3+3H2O,CuO+2HCl=CuCl2+H2O。
(4)氧元素显-2价,设硅元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)×2=0,则x=+4价;
(5)要使Mg(OH)2纯度高、损失少,必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内,即6.7<pH<8.6的范围内;所以溶液B中一定含有的溶质为氯化镁和反应生成的氯化钙,化学式分别是MgCl2、CaCl2。

【题目】干燥剂“碱石灰”是氧化钙和氢氧化钠的混合物,在空气中容易变质。某研究小组对一只干燥管里的“碱石灰”样品的成分进行实验探究。
【提出猜想】
猜想Ⅰ:没有变质,只含有氧化钙和氢氧化钠。
猜想Ⅱ:部分变质,含有……
猜想Ⅲ:完全变质,只含有碳酸钙、碳酸钠。
【实验探究】
操作 | 现象 | 结论 |
① | 试管外壁发烫,得到浑浊的液体。 | 推测样品中含有_______________ |
② | 滤渣溶解,产生大量气泡。 | 写出产生大量气泡的化学方程式: _______________ |
③ | 产生白色沉淀。 | 写出产生白色沉淀的化学方程式: _______________ |
【小结与思考】
⑴从上述实验现象推断:猜想________成立。
⑵“碱石灰”样品里是否一定含有碳酸钙?请说明理由。____________________________。
【题目】下列4个图像中,能正确反映对应变化关系的是
|
|
|
|
A.向一定质量的碳酸钙粉末中加入稀盐酸至过量 | B.向少量的稀硫酸中加入锌片 | C.加热一定质量的高锰酸钾固体 | D.向一定质量的二氧化锰中加入过氧化氢溶液 |
A. A B. B C. C D. D