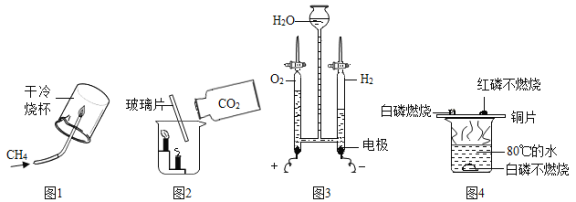
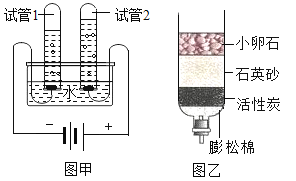
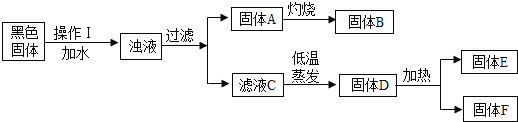
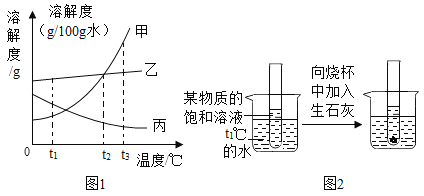
��Ŀ����
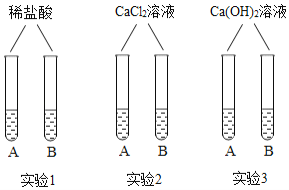
����Ŀ��Ϊ̽��CO2��NaOH��Һ�ķ�Ӧ��ijͬѧ����������ʵ�顣������롣
(1)��NaOH��Һ��ͨ��CO2��������Ӧ�Ļ�ѧ����ʽΪ____________��������ͨ��CO2��������Ӧ�ķ���ʽΪ![]() ______________(������������Ļ�ѧʽ)��
______________(������������Ļ�ѧʽ)��
(2)��ȡNaOH��Һ��ͨ��CO2���õ���ҺM����M�еμ�ϡ���ᣬ�۲쵽__________�����ɴ�֤��CO2��NaOH�����˷�Ӧ��
(3)ȡ������ҺM����������NaOH��Һ���õ�����Һ������ֻ��Na2CO3����M�����ʿ�����_________����ط�Ӧ�Ļ�ѧ��Ӧ����ʽΪ__________________��
���𰸡�2NaOH+CO2��Na2CO3+H2O NaHCO3 �����ݲ��� Na2CO3��NaHCO3��NaHCO3 NaHCO3+NaOH��Na2CO3+H2O
��������
��1�������������ƺͶ�����̼��Ӧ����̼���ƺ�ˮ���Լ���ѧ��Ӧǰ��Ԫ������䣬ԭ�Ӹ���������з�����
��2������̼���κ��ᷴӦ�������ɶ�����̼���з�����
��3������̼�����ƺ��������Ʒ�Ӧ����̼���ƺͶ�����̼���з�����
��1���������ƺͶ�����̼��Ӧ����̼���ƺ�ˮ����ѧ����ʽΪ��2NaOH+CO2��Na2CO3+H2O����ѧ��Ӧǰ��Ԫ������䣬ԭ�Ӹ������䣬��Ӧ������2��̼ԭ�ӡ�2����ԭ�ӡ�2����ԭ�ӡ�6����ԭ�ӣ����Կհ״���NaHCO3��
��2��̼���κ��ᷴӦ�����ɶ�����̼���������ݣ�����ȡNaOH��Һ��ͨ��CO2���õ���ҺM����M�еμ�������ϡ���ᣬ�۲쵽�����ݲ��������ɴ�֤��CO2��NaOH�����˷�Ӧ��
��3��̼�����ƺ��������Ʒ�Ӧ����̼���ơ�ˮ������M�����ʿ�����Na2CO3��NaHCO3��NaHCO3����ط�Ӧ�Ļ�ѧ��Ӧ����ʽΪ��NaHCO3+NaOH��Na2CO3+H2O��
�ʴ�Ϊ����1��2NaOH+CO2��Na2CO3+H2O��NaHCO3��
��2�������ݲ�����
��3��Na2CO3��NaHCO3��NaHCO3��NaHCO3+NaOH��Na2CO3+H2O��

����Ŀ����ѧʵ����̾�������������ķ�Һ������������������Ч��ֹˮ����Ⱦ����һ��ʵ����ϣ���ȤС���ͬѧ�������NaOH��Һ��Na2CO3��Һ�ļ��𣬲��Է�Һ�ɷ�չ��̽����
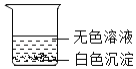
�һ ͨ��С�������ͬѧ���������ͼ��ʾ������Сʵ�顣ʵ�������ɰ�ɫ�����Ļ�ѧ����ʽ��_��дһ������
��� Сѩ����֧�Թ��е�ʣ���ﵹ��һ���ྻ�Ĵ��ձ��У���ͼ������ֽ��衢���ã��۲쵽�����ϲ�����ɫ��Һ���²��а�ɫ�������ɴ˿���ȷ�����ϲ���Һ��һ�������е�������_���Լ�һ�����е����ӡ�С��ͬѧ���ϲ���Һ�л����ܺ��е����ӽ���������̽����
��������⣩�ϲ���Һ�л����ܺ���ʲô���ӣ�
����������裩�ϲ���Һ�л����ܺ���OH����CO32����Ca2+�е�һ�ֻ��֡�
������ʵ�飩
ʵ�鲽�� | ʵ������ | ʵ����� | |
����һ | ��ȡ������Һ���Թ��У��μ���ɫ��̪��Һ �ڼ����μ�ϡ���� | ����Һ��� �ڲ������� | ����OH�� ����CO32����Ca2+ |
������ | ȡ������Һ���Թ��У�__���������ɣ���ָʾ�����⣩ | _���������ɣ� | ����CO32������Ca2+����OH�� |
����˼�����ۣ�
��1��С��ͬѧ�Է���������ɣ�����������___�� �������ɣ���
��2�������ۺϷ���������ȷ���ϲ���Һ�п϶����ڵ�������___��
��3�����ձ������ʹ��ˣ��������գ�����Һ�м�������__�� �������ɣ����д��������ŷš�
����Ŀ��ʵ�������������Ʒ�������ʣ�Ϊ�˲ⶨ��Ʒ������ص�����������ȡ 10g ����Ʒ�� 1g �������̻�ϼ��� t1 ʱ��������ʲ��μӷ�Ӧ������ȴ������ʣ������������ظ����ϲ��������γƵü��� t2��t3��t4 ʱ���ʣ��������������¼�������±���
����ʱ�� | t1 | t2 | t3 | t4 |
ʣ���������/g | 10.04 | 9.08 | 8.12 | 8.12 |
��1��������ȫ��Ӧ���������������Ϊ_____g ��
��2�������Ʒ������ص���������_____��Ҫ��д��������̣�����Ӧ�Ļ�ѧ����ʽΪ��2KClO3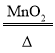 2KCl+ 3O2��
2KCl+ 3O2��