题目内容
【题目】某电镀厂为减少污染及节约成本,从含有硫酸铜、硫酸锌、硫酸亚铁的废水中回收重要原料硫酸锌和有有关金属,实验过程如图:
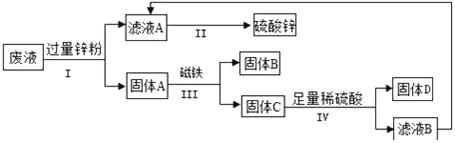
①步骤 I、IV 包含的相同操作是_____。
②写出步骤 I 中反应的化学方程式_____。
③上述步骤_____(选填步骤编号)所包含的反应体现了锌的活动性比铜强。
④要计算废液中硫酸铜质量,必须要称量_____的质量。(实验过程中的物质损失忽略不计)
⑤判断步骤 IV 中加入的稀硫酸足量的方法是_____。
【答案】过滤 Zn+CuSO4→ZnSO4+Cu、Zn+FeSO4→ZnSO4+Fe I、IV 固体 D 继续滴加稀硫酸,振荡,无气泡产生
【解析】
①步骤 I、IV 都将固体和液体分离,包含的相同操作是过滤;
②步骤 I 过量的锌,目的是使溶液中的CuSO4和FeSO4充分反应;锌与硫酸铜反应硫酸锌和铜,锌与硫酸亚铁反应生成硫酸锌和铁,反应的化学方程式分别为:Zn+CuSO4→ZnSO4+Cu、Zn+FeSO4→ZnSO4+Fe;
③锌与硫酸铜反应生成硫酸锌和铜,说明锌的活动性比铜强;锌和稀硫酸反应而铜不反应,说明锌的活动性比铜强。上述步骤I、IV所包含的反应体现了锌的活动性比铜强;
④要计算废液中硫酸铜质量,可根据化学方程式:Zn+CuSO4→ZnSO4+Cu进行计算,必须要称量铜的质量,即固体D的质量;
⑤步骤 IV 中加入的稀硫酸足量时,固体C中的锌已经完全消耗,判断步骤 IV 中加入的稀硫酸足量的方法是继续滴加稀硫酸,振荡,无气泡产生。

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目