题目内容
【题目】同学们利用下图所示装置进行气体的制备实验(A~E为装置编号)。
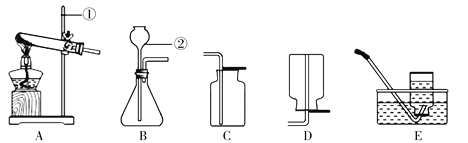
(1)写出图中标示的仪器名称:①______________________,②____________________。
(2)实验室用高锰酸钾制取氧气的化学方程式为__________________________________,
可选用的发生装置是____________。
(3)如果用E装置收集到的氧气不纯,可能原因是__________________________(写出一种)。
(4)实验室用锌粒和稀盐酸制取氢气的化学方程式为____________________________,可选用B为发生装置,如果用注射器替换仪器②,其优点是__________________________。
(5)用质量分数为20%的盐酸与足量大理石反应,消耗73g盐酸,最多可生成二氧化碳的质量是多少?(根据化学方程式进行计算,在答题纸上写出计算过程)____________
【答案】 铁架台 长颈漏斗 2KMnO4![]() K2MnO4 + MnO2 + O2↑ A 气泡未连续均匀冒出时就收集(或收集前集气瓶中未装满水等合理答案) Zn +2HCl =ZnCl2+H2↑ 可控制反应快慢 8.8g
K2MnO4 + MnO2 + O2↑ A 气泡未连续均匀冒出时就收集(或收集前集气瓶中未装满水等合理答案) Zn +2HCl =ZnCl2+H2↑ 可控制反应快慢 8.8g
【解析】根据所学知识和题中信息知,(1)图中标示的仪器名称:①铁架台 ②长颈漏斗。(2)实验室用高锰酸钾制取氧气的化学方程式为2KMnO4 ![]() K2MnO4 + MnO2 + O2↑,可选用的发生装置是A。 (3)如果用E装置收集到的氧气不纯,可能原因是气泡未连续均匀冒出时就收集(或收集前集气瓶中未装满水等合理答案)。 (4)实验室用锌粒和稀盐酸制取氢气的化学方程式为 Zn +2HCl =ZnCl2+H2↑。可选用B为发生装置,如果用注射器替换仪器②,其优点是可控制反应快慢。
K2MnO4 + MnO2 + O2↑,可选用的发生装置是A。 (3)如果用E装置收集到的氧气不纯,可能原因是气泡未连续均匀冒出时就收集(或收集前集气瓶中未装满水等合理答案)。 (4)实验室用锌粒和稀盐酸制取氢气的化学方程式为 Zn +2HCl =ZnCl2+H2↑。可选用B为发生装置,如果用注射器替换仪器②,其优点是可控制反应快慢。
(5)解∶设最多可生成二氧化碳的质量为xg
CaCO3 +2HCl=CaCl2 +H2O+CO2 ↑
73 44
20%×73g x
![]() =
=![]() ,x=8.8g.
,x=8.8g.
答∶最多可生成二氧化碳的质量为8.8g.
点睛∶本题主要考查实验室制取氧气,氢气的装置,原理,收集方法以及根据化学方程式进行计算。

 阅读快车系列答案
阅读快车系列答案【题目】a、b可发生化合反应生成c。小辰做了两次该实验(每次均充分反应),反应前a、b的质量总和都是9g,实验数据如下表。则m : n的值为
序号 | 反应前a的质量/g | 反应前b的质量/g | 反应后c的质量/g |
① | 7 | 2 | 6 |
② | m | n | 9 |
A. 5:4 B. 2:7 C. 2:1 D. 1:8