题目内容
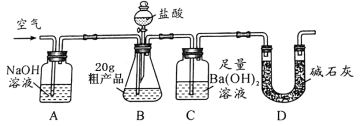
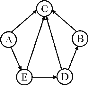
【题目】如图是关于初中化学常见的五种物质的转化关系网络(其他反应物和生成物已略去)。其中A是黑色固体,B为红棕色固体,C、D、E常温下均为气体,C的相对分子质量大于E。请回答:
(1)A的化学式____________________;D的化学式____________________。
(2)写出B向C转化的反应方程式____________________。
【答案】(1)C O2
(2)3CO+ Fe2O3 高温 2Fe + 3CO2或3C+ 2Fe2O3 高温 4Fe + 3CO2↑
【解析】
试题分析:框图式的推断题,抓住一些特殊的反应现象、特殊的性质及特殊的反应条件等级题目的“题眼”, 该题的题眼B为红棕色固体,可判断为氧化铁,C为气体,由B转化而来,可判断为二氧化碳,A是黑色固体,可能是碳、氧化铁,二氧化锰等,但要转化为气体E,且气体E能转化为C,C的相对分子质量大于E,故可判断E应为一氧化碳,那么A应为碳,D能与E反应,且能转化为氧化铁,故可判断D为氧气
(1)A为碳,化学式为:C ;D为氧气,化学式:O2
(2)B为氧化铁,C为二氧化碳,故B向C转化的反应方程式为:3CO+ Fe2O3 高温 2Fe + 3CO2或3C+ 2Fe2O3 高温 4Fe + 3CO2↑

 阅读快车系列答案
阅读快车系列答案【题目】(13分)中和反应是一类重要的反应。根据要求回答问题:
(1)许多物质在溶液中以离子形式存在。下图表示HCl、NaOH溶液及两者混合后溶质在溶液中的存在情况。
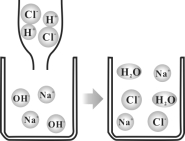
①盐酸具有酸的特性,是因为盐酸溶液中含有 (填微粒符号)。
②对比分析盐酸与氢氧化钠溶液混合前后溶液离子存在情况,可知两者反应时不会减少的离子是 。
③教材指出:酸与碱中和反应的结果是酸和碱各自的特性都消失。请结合上图并从微粒的角度分析,盐酸与氢氧化钠反应时,为何酸、碱各自的特性都消失?答: 。
(2)日常生活中,凡是使酸的酸性消失或碱的碱性消失的反应均被称为“中和”。如使用碳酸氢钠(其溶液显碱性)治疗胃酸(主要成分为盐酸)过多症,就因碳酸氢钠能使胃酸的酸性消失,而称为碳酸氢钠“中和”了过多的胃酸。现有碳酸氢钠溶液、酚酞溶液和盐酸溶液,设计实验证明碳酸氢钠溶液与盐酸反应时,碳酸氢钠溶液的碱性、盐酸的酸性都将各自消失。
操作 | 现象 | 结论 |
实验1:往装有碳酸氢钠溶液的试管中先加入2-3滴酚酞溶液,再逐滴加入盐酸直至恰好完全反应 | 滴入酚酞时的现象: ; 逐滴加入盐酸的现象: ________________。 | 两者反应时,碳酸氢钠溶液碱性消失 |
实验2: | 两者反应时,盐酸溶液酸性消失 |