��Ŀ����
����Ŀ��С��ͬѧ�μ�Ұ�������������ζ��ʱ��С�Ľ�һƿ�״������ڻ�¯�Ե�һ�Ѳ�ľ���ϣ������д������������ɡ���������Ȥ��������������ѧϰС���ͬѧ���Բ�ľ�ҵijɷֽ���̽����
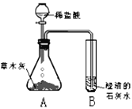
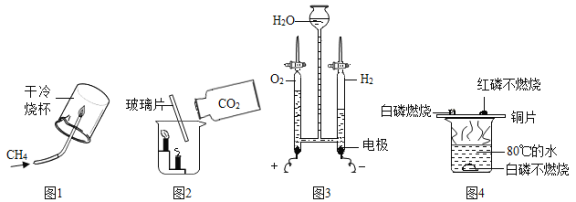
��̽���1��������ѧ֪ʶ��ͬѧ�Dz����ľ���к��������ᷴӦ����������������ʣ����ǣ���Ʋ���������ͼ��ʾ��ʵ�顣
[����] �۲쵽��ƿA���д���������ð�����Թ�B�г����ʯ��ˮ����ǡ�
[�ƶ�] �Թ�B ���йط�Ӧ�Ļ�ѧ����ʽΪ _______________��
[����] ��ľ����һ������_________��ѡ����������������̼����������������������
��̽���2��ͬѧ����Ϊ������Բ�ľ���д��ڵ����������������Ľ���Ԫ�ؽ���̽����
[����ժҪ]
��.���ֽ���������������ʱ�������Ļ�����ָ����������ɫ���磺
��������������Ԫ�� | ��Ԫ�� | ��Ԫ�� | ͭԪ�� |
���ղ���������ɫ | ש��ɫ | ��ɫ������ɫ�ܲ���Ƭ�� | ��ɫ |
��.̼�����̼���ơ�̼�������̼�����ƻ�ѧ�������ƣ�̼���������ʲ��ȶ��������ֽ⡣
��1��ͬѧ������ʦ��ָ���£�ȡ��ľ����Ʒ�ڻ��������գ�����ɫ�ܲ���Ƭ�۲쵽�����__ɫ���ɴ˵ó���ľ�Һ��м�Ԫ�صĽ��ۡ�
��2���ۺ�����̽���������һ���²��ľ���к��еļ����ǣ�a. KHCO3 b��K2CO3 c��_____��
��3��С����Ϊ�����²�_____�Ǵ���ġ������Dz�ľ�Ҿ����ȼ�ն��ɣ�_______��
��4������д��������̽���1���У���ƿA �ڷ�����һ����Ӧ�Ļ�ѧ����ʽ��_________��������ľ�ҵ���;֮һ_______�� ��ʦָ������ľ�ҳɷָ��ӣ��������������ɷֵ�̽���д�ͬѧ�Ǻ������С�
���𰸡�CO2+Ca��OH��2�TCaCO3��+H2O ̼���� �� K2CO3��KHCO3 a��c ���в����ܴ��������ֽ��KHCO3 K2CO3+2HCl�T2KCl+H2O+CO2�� �����ط�
��������
[̽���һ]��
[�ƶ�]������̼��ʹ����ʯ��ˮ����ǣ������������к��ж�����̼���йط�Ӧ�Ļ�ѧ����ʽΪCO2+Ca��OH��2�TCaCO3��+H2O��
[����]̼���κ�ϡ���ᷴӦ���ɶ�����̼��������ѧ֪ʶ���ɵó����½��ۣ���ľ����һ������̼���Σ�
[̽�����]����1��������ժҪ��֪��Ԫ���ڻ��������գ�����ɫ�ܲ���Ƭ�۲쵽�������ɫ��
��2��̼�����Լ�̼�����ο��Ժ����ᷴӦ�ų�������̼�����в��룺a��KHCO3��b��K2CO3��c��K2CO3��KHCO3��
��3������������֪����ľ���Dz��ȼ�յõ��IJ�������ܴ��������ֽ��KHCO3������a��c�������
��4��̼��غ����ᷴӦ�����Ȼ��ء�ˮ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ��K2CO3+2HCl�T2KCl+H2O+CO2����̼����к��м�Ԫ�أ����Կ������طʣ�
�ʴ�Ϊ��[̽���1]��CO2+Ca��OH��2�TCaCO3��+H2O��̼���Σ�
[̽���2]��
��1���ϣ�
��2��K2CO3��KHCO3��
��3��a��c�����в����ܴ��������ֽ��KHCO3��
��4��K2CO3+2HCl�T2KCl+H2O+CO2���������طʣ�

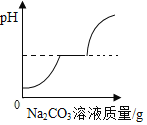
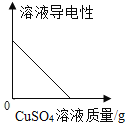
����Ŀ���±�ʵ�������еĺᡢ�������ʾ����������ͼ��ʾ�仯���Ƶ���
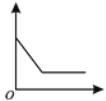
��� | ʵ������ | �������ʾ���� | �������ʾ���� |
�� | �����ˮϡ�� | ����ˮ����� | ��Һ��pH |
�� | �������ײⶨ�������������� | ʱ �� | �������� |
�� | ����������Һ��������������� | ʱ �� | ������������ |
�� | ��ͭ��п������ĩ�м������� | �������� | ʣ��������� |
A.�٢�B.�٢�
C.�ڢ�D.�ڢ�
����Ŀ��![]() Ϊ��ɫ��������Ϊ�˱��������䣬��ҵ�ϲ��á�������������ת���ɹ�̬��̼���ƾ��壨��ѧʽΪ
Ϊ��ɫ��������Ϊ�˱��������䣬��ҵ�ϲ��á�������������ת���ɹ�̬��̼���ƾ��壨��ѧʽΪ![]() ������̼��������ˮʱ�ַֽ�����̼���ƺ������⡣
������̼��������ˮʱ�ַֽ�����̼���ƺ������⡣
��1�����������������Ĺ����������£�
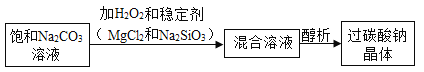
д�����ɹ�̼���ƾ���Ļ�ѧ����ʽ��_____��
��2��ͼ����һ����Ϊ�����ձ�ը�Ρ���ϴ��Ʒ���ܸ�Чȥ�ۡ�С��ͬѧ��ͨ��ʵ����֤����Ҫ�ɷ֡�
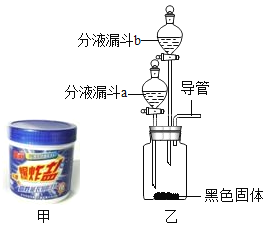
���������ϣ������ձ�ը�Ρ�����Ҫ�ɷ��ǹ�̼���ơ�
�������ʵ�飩
С��ͬѧ��Ƶ���Ҫʵ��װ����ͼ����ʾ���������ó�����ѧ֪ʶ������С��ͬѧ�������ʵ�鱨�档
��� | ��Ҫ�������� | ��Ҫʵ������ |
�� | �ڼ���ƿ�м�������_____����ɫ���壩�� �ڷ�Һ©��a�м��������Ƶ������ձ�ը�����ı���ˮ��Һ�� �ڷ�Һ©��b�м���_____��Һ���������վ��ѧʽ�� | |
�� | ��Һ©��a�Ļ������ų�������Һ�رջ��� | ���������������� |
Ȼ����_____�ӽ����ܿ� | _____ | |
���ۣ������ձ�ը��������ˮ����_____�����������ƣ� | ||
�� | ����������Ӧֹͣ��Һ©��b�Ļ������ų�������Һ�رջ��� | ������ɫ���� |
���ۣ������ձ�ը��������ˮ����_____�����������ƣ� | ||
��ʵ�鷴˼��
�ٱ��桰���ձ�ը�Ρ�ʱҪע��_____��дһ������
��Ϊ�˽�һ��ȷ�������ձ�ը�Ρ��й�̼���Ƶĺ�������ѡ���������_____��ѡ����ĸ����
A ���������������
B �����İ�ɫ����������
C ��Һ©��a��Һ�������
D ��Һ©��b��Һ�������
����Ŀ��������ij��ѧ��ȤС���ͬѧ���������Ʋ������ʵ�̽�����̣�
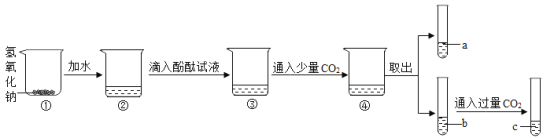
��1�����ִ����ڵ��ձ���ڣ��о����̣����������������ƹ�������ˮʱ��_______�����������������������������е���Һ��_______ɫ��
��2���Ӣ۵�����Һ����ɫ�仯�����ԣ�˵�����е���Һ��______�ԣ���������������������
��3��c��Һ��a��Һ�Աȣ�c��Һ��ɫ��dz��
��������⣩Ϊʲô����ͨ������Ķ�����̼������Һ��ɫ���dz��
���������ϣ���1��Na2CO3+CO2+H2O==2NaHCO3 ��2��Ca(NO3)2��Һ��NaHCO3��Һ����Ӧ
�����ʵ�飩
ʵ����� | ʵ������ | ʵ����� |
ȡ����c��Һ����ϡ���� | �� ____ | ��Һ�к��϶��CO32����HCO3�� |
��ȡ����c��Һ�����������Һ | ���������� | ��Һ��û�д�����____���� |
��ʵ����ۣ����ݼס�������ʵ��ó��Ľ��ۣ�д����ʵ���з�����Ӧ�Ļ�ѧ����ʽ��_____________________________��
��ʵ�鷴˼��ͬ�ַ�Ӧ���ڲ�ͬ�������·�����ѧ��Ӧʱ�����ܵõ���ͬ�IJ���磺̼��������ȼ�տ�������________��________��
��ʵ����չ��106g10% Na2CO3��Һ��Ca(NO3)2��ȫ��Ӧ���ɳ��� ______g