题目内容
根据下列装置图回答问题。

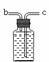
Ⅰ.写出仪器①的名称是 ⑻ ,仪器②的名称 ⑼ 。
Ⅱ.实验室用一定质量的氯 酸钾制取氧气,通过排水量测定所收集到的氧气体积。
酸钾制取氧气,通过排水量测定所收集到的氧气体积。
①写出该反应的化学方程式 ⑽ 。
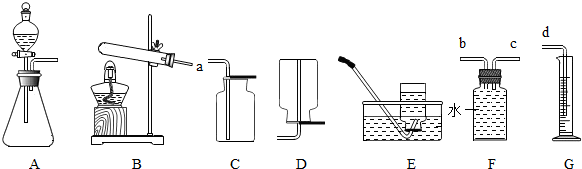
②若各装置的连接顺序是:a→b→c→d,H装置内导管(“b”或“c”)该怎样延伸?请画出⑾ 。
③根据氯酸钾的质量算出的氧气体积为理论值.如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因是 ⑿ 。
Ⅲ.某兴趣小组为了选择实验室制取二氧化碳的原料,对影响盐酸与大理石(大理石中杂质不与盐酸反应)反应的速率快慢的因素展开研究。
提出假设:盐酸与大理石反应的速率快慢与所用HCl的质量分数、大理石颗粒大小有关。
实验设计与实施:
| 实验编号 | 温度 | 5克大理石(碳酸钙纯度相同)规格 | 20克HCl的质量分数 | 完全反应所需时间/s |
| 实验① | 20℃ | 粗颗粒 | 20% | 140 |
| 实验② | 20℃ | 粗颗粒 | 10% | 220 |
| 实验③ | 20℃ | 细颗粒 | 20% | 30 |
根据以上信息回答下列问题:
写出上述实验中反应的化学方程式 ⒀ 。
实验①与②的目的是为了探究 ⒁ 。
实验 ⒂ (填实验编号)的目的是为了探究大理石颗粒粗、细对反应快慢的影响。
实验结论:HCl质量分数越大,反应越快;固体的颗粒越小,反应越快。
拓展与反思:还有哪些因素可能影响该反应的速率快慢呢?请写出你的一个猜想: ⒃ 。
根据上述实验探究,实验室选用块状大理石与稀盐酸制取二氧化碳,选用上图中具有启普发生器原理 的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
Ⅳ.实验室在常温下用块状电石固体与水反应制取乙炔气体, 该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。
该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。
| ⑻ | 长颈漏斗 | 1 | 错别字不得分 | |
| ⑼ | 集气瓶 | 1 | 错别字不得分 | |
| Ⅱ | ⑽ | 2KClO3 | 1 | |
| ⑾ |
| 1 | 导管接近瓶底给分 | |
| ⑿ | 试管内空气未排净就立即收集气体 | 1 | ||
| Ⅲ | ⒀ | CaCO3+2HCl→CaCl2+CO2↑+H2O | 1 | |
| ⒁ | HCl的质量分数大小对该反应快慢的影响 | 1 | ||
| ⒂ | ①和③ | 1 | 答全给分 | |
| ⒃ | 反应物的温度或不同种类的酸或大理石中碳酸钙的含量 | 1 | 合理给分 | |
| ⒄ | D | 1 | ||
| ⒅ | C和G | 1 | 答全给分,有错不得分 |

 名校课堂系列答案
名校课堂系列答案 2KCl+3O2↑
2KCl+3O2↑