题目内容
根据下列装置图回答问题.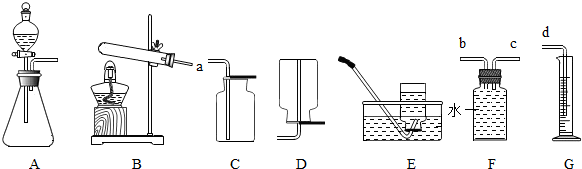
(1)甲、乙两位同学要选用该图中的装置A用过氧化氢溶液和二氧化锰制取氧气,试回答:
①分液漏斗中应该加入的物质是
②甲、乙两位同学在制取氧气时,选用了相同的气体发生装置,但其收集装置不同,通过对比知道,甲收集的氧气比乙纯.则甲选
③甲选择该装置收集的依据是
④甲同学在开始实验时,观察到锥形瓶内有大量气泡产生,可收集装置中并没收集到气体,其原因是
⑤装置A中反应很剧烈,据此,他们应该采用的安全方法是
Ⅰ、控制液体流速;Ⅱ、用体积小的锥形瓶;Ⅲ、加热反应物
(2)若用一定质量的高锰酸钾制取氧气,通过排水量测定所收集到的氧气体积(装置选用B、F、G).
①写出该反应的化学方程式
②若各装置连接顺序是:a→b→c→d,F装置内导管(“b”或“c”)该怎样延伸?请画出.
③根据高锰酸钾的质量算出的氧气体积为理论值.如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因是
④若改用氯酸钾和二氧化锰来制取氧气,则二氧化锰在反应前后固体混合物中的质量分数将

(1)甲、乙两位同学要选用该图中的装置A用过氧化氢溶液和二氧化锰制取氧气,试回答:
①分液漏斗中应该加入的物质是
过氧化氢溶液
过氧化氢溶液
,锥形瓶中放入的物质是二氧化锰
二氧化锰
.②甲、乙两位同学在制取氧气时,选用了相同的气体发生装置,但其收集装置不同,通过对比知道,甲收集的氧气比乙纯.则甲选
E
E
装置收集,乙选C
C
装置收集.③甲选择该装置收集的依据是
氧气不易溶于水
氧气不易溶于水
,如何知道已集满了一瓶氧气?集气瓶口有大气泡逸出时
集气瓶口有大气泡逸出时
.④甲同学在开始实验时,观察到锥形瓶内有大量气泡产生,可收集装置中并没收集到气体,其原因是
装置漏气
装置漏气
.⑤装置A中反应很剧烈,据此,他们应该采用的安全方法是
Ⅰ
Ⅰ
.Ⅰ、控制液体流速;Ⅱ、用体积小的锥形瓶;Ⅲ、加热反应物
(2)若用一定质量的高锰酸钾制取氧气,通过排水量测定所收集到的氧气体积(装置选用B、F、G).
①写出该反应的化学方程式
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
②若各装置连接顺序是:a→b→c→d,F装置内导管(“b”或“c”)该怎样延伸?请画出.
③根据高锰酸钾的质量算出的氧气体积为理论值.如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因是
可能是锰酸钾或二氧化锰分解放出氧气(合理均可)
可能是锰酸钾或二氧化锰分解放出氧气(合理均可)
.④若改用氯酸钾和二氧化锰来制取氧气,则二氧化锰在反应前后固体混合物中的质量分数将
变大
变大
(填“变大”、“变小”或“不变”)分析:(1)①过氧化氢溶液是液体,二氧化锰是固体,并结合实验装置分析解答;
②利用排水法收集 的气体比排空气法收集的气体纯净,并结合氧气的密度和溶解性分析解答;
③氧气不易溶于水,所以可用排水法收集,并据排水法收集气体的注意事项分析回答;
④锥形瓶内有大量气泡产生,可收集装置中并没收集到气体,说明装置漏气,气体泄漏;
⑤为安全起见,可减少反应物的量、或降低反应物的浓度;
(2)①据反应原理正确书写高锰酸钾制取氧气的化学方程式;
②若各装置的连接顺序是:a→b→c→d,F装置内导管,c管延长,有利于排水;
③加热高锰酸钾生成氧气的量大于理论值,可能是锰酸钾或二氧化锰也能分解生成氧气;
④二氧化锰是氯酸钾分解的催化剂,其质量在化学反应前后不变,并结合反应原理分析解答.
②利用排水法收集 的气体比排空气法收集的气体纯净,并结合氧气的密度和溶解性分析解答;
③氧气不易溶于水,所以可用排水法收集,并据排水法收集气体的注意事项分析回答;
④锥形瓶内有大量气泡产生,可收集装置中并没收集到气体,说明装置漏气,气体泄漏;
⑤为安全起见,可减少反应物的量、或降低反应物的浓度;
(2)①据反应原理正确书写高锰酸钾制取氧气的化学方程式;
②若各装置的连接顺序是:a→b→c→d,F装置内导管,c管延长,有利于排水;
③加热高锰酸钾生成氧气的量大于理论值,可能是锰酸钾或二氧化锰也能分解生成氧气;
④二氧化锰是氯酸钾分解的催化剂,其质量在化学反应前后不变,并结合反应原理分析解答.
解答:解:(1)①过氧化氢溶液是液体,二氧化锰是固体,分液漏斗可加入液体,故分液漏斗中放入的是过氧化氢溶液,锥形瓶中放入的是二氧化锰;
②氧气不易溶于水且密度比空气大,所以可用排水法或向上排空气法收集,利用排水法收集 的气体比排空气法收集的气体纯净,甲收集的氧气比乙纯说明甲用的是排水法,乙用的是向上排空气法收集;
③氧气不易溶于水,所以可用排水法收集,当瓶口有气泡冒出时说明收集满了;
④锥形瓶内有大量气泡产生,可收集装置中并没收集到气体,说明装置漏气,气体泄漏;
⑤控制液体流速,可控制反应物的量,进而控制反应速率;用体积小的锥形瓶,空间有限,存在安全隐患,加热反应物,生成气体的速率加快,不安全;
(2)①加热高锰酸钾制取氧气,同时生成锰酸钾、二氧化锰和氧气,化学方程式是:2KMnO4
K2MnO4+MnO2+O2↑;
②若各装置的连接顺序是:a→b→c→d,F装置内导管,c管延长,有利于排水,从而通过测量水的体积测量氧气的体积,故如图 ;
;
③加热高锰酸钾生成氧气的量大于理论值,根据反应前后元素的质量不变,所以可能是锰酸钾或二氧化锰也能分解生成氧气;
④二氧化锰是氯酸钾分解的催化剂,其质量在化学反应前后不变,而氯酸钾分解生成氧气,所以二氧化锰在固体混合物中的质量分数将变大;
故答案为:
(1)①过氧化氢溶液;二氧化锰;
②E;C;
③氧气不易溶于水; 集气瓶口有大气泡逸出时;
④装置漏气;
⑤Ⅰ;
(2)①2KMnO4
K2MnO4+MnO2+O2↑
② ;
;
③可能是锰酸钾或二氧化锰分解放出氧气(合理均可);
④变大.
②氧气不易溶于水且密度比空气大,所以可用排水法或向上排空气法收集,利用排水法收集 的气体比排空气法收集的气体纯净,甲收集的氧气比乙纯说明甲用的是排水法,乙用的是向上排空气法收集;
③氧气不易溶于水,所以可用排水法收集,当瓶口有气泡冒出时说明收集满了;
④锥形瓶内有大量气泡产生,可收集装置中并没收集到气体,说明装置漏气,气体泄漏;
⑤控制液体流速,可控制反应物的量,进而控制反应速率;用体积小的锥形瓶,空间有限,存在安全隐患,加热反应物,生成气体的速率加快,不安全;
(2)①加热高锰酸钾制取氧气,同时生成锰酸钾、二氧化锰和氧气,化学方程式是:2KMnO4
| ||
②若各装置的连接顺序是:a→b→c→d,F装置内导管,c管延长,有利于排水,从而通过测量水的体积测量氧气的体积,故如图
 ;
;③加热高锰酸钾生成氧气的量大于理论值,根据反应前后元素的质量不变,所以可能是锰酸钾或二氧化锰也能分解生成氧气;
④二氧化锰是氯酸钾分解的催化剂,其质量在化学反应前后不变,而氯酸钾分解生成氧气,所以二氧化锰在固体混合物中的质量分数将变大;
故答案为:
(1)①过氧化氢溶液;二氧化锰;
②E;C;
③氧气不易溶于水; 集气瓶口有大气泡逸出时;
④装置漏气;
⑤Ⅰ;
(2)①2KMnO4
| ||
②
 ;
;③可能是锰酸钾或二氧化锰分解放出氧气(合理均可);
④变大.
点评:本题主要考查了实验室发生和收集装置的选取,选择发生装置通常考虑反应物的状态和反应条件,选择气体的收集方法通常依据气体的密度和溶解性;并根据题目中的信息正确有关书写化学方程式等知识,考查学生分析、解决问题的能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目