题目内容
【题目】氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
Ⅰ.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:
3ZnO + 2Fe3O4 + H2O![]() 3ZnFe2O4 + H2↑;6ZnFe2O4
3ZnFe2O4 + H2↑;6ZnFe2O4![]() 6ZnO + 4Fe3O4 + O2↑
6ZnO + 4Fe3O4 + O2↑
(1)ZnFe2O4中Fe的化合价为________。
(2)该循环制氢中不断消耗的物质是_______(填化学式)。
Ⅱ.贮氢:合金Mg2Cu是一种贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu + 3H2 ![]() 3MgH2 + MgCu2
3MgH2 + MgCu2
(3)熔炼制备Mg2Cu合金时,通入氩气的目的是_______。
(4)氢化物MgH2中氢元素的质量分数为______(精确到0.1% )。
【答案】+3 H2O 防止金属被氧化 7.7%
【解析】
(1)在ZnFe2O4中,锌的化合价为+2价,氧元素的化合价为﹣2,设:Fe的化合价为x,根据化合物中各元素化合价的代数和为零,则有(+2)+2x+(﹣2)×4=0,x=+3;
(2)根据化学方程式可知,该循环制氢中不断消耗的物质是水,其化学式为H2O;
(3)熔炼制备Mg2Cu合金时,在350℃时,镁、铜能与空气中的氧气反应,通入氩气可以起到保护作用,防止金属被氧化;
(4)氢化物MgH2中氢元素的质量分数=![]() 。
。

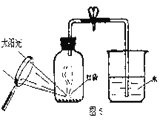
【题目】被称为“生命之源”的水和被称为“绿色氧化剂”的双氧水(过氧化氢溶液),通常情况下均为无色液体。在化学实验开放日,实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容:
实验步骤 | 实验现象 | 实验结论 |
取少量的两种无色液体分别加入A、B两个试管中; (1)______ | A试管中(2)_________ B试管中试管中有气泡产生 | A试管中的无色液体是(3):_______; B试管中的无色液体是(4):_______。 |
(5)B试管中发生反应的文字表达式: _______。
(6)如何验证B试管中产生的气体(写出操作步骤、实验现象和结论)___________
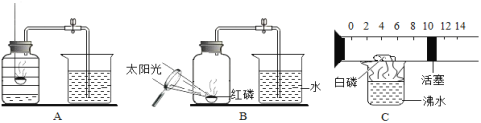
【题目】化学兴趣小组就空气中氧气的含量进行实验探究:
[集体讨论]
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择_________(填字母)。
A.蜡烛B.红磷 C.硫粉 D. 铁丝
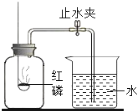
(2)小组同学共同设计了实验装置,为了确保实验的成功,在装药品之前应该_________。
[分组实验]在讨论的基础上,他们分组进行了实验。
[数据分析]实验结束后,整理数据如下:(注:集气瓶容积为100 mL)
组 别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积(mL) | 20 | 21 | 19 | 20 | 22 | 20 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的_____________。
(4)写出红磷在空气中燃烧反应的符号表达式:______________
[实验拓展]
(5)某同学对实验进行反思后,提出了改进方法(图5所示)。你认为改进后的优点是:______。