题目内容
在含有硫酸钾和碳酸钾的混合溶液中,加入足量的氯化钡溶液,生成沉淀8.6g,若将沉淀用足量的稀盐酸处理,可放出0.88g气体,求原混合溶液中含硫酸钾和碳酸钾各多少克?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:氯化钡和硫酸钾反应生成硫酸钡沉淀和氯化钾,硫酸钡不溶于稀盐酸;
氯化钡和碳酸钾反应生成碳酸钡沉淀和氯化钾,碳酸钡和稀盐酸反应生成氯化钡、水和二氧化碳;
根据生成二氧化碳的质量可以计算碳酸钡的质量,根据沉淀总质量可以计算硫酸钡的质量,进一步可以计算原混合溶液中含硫酸钾和碳酸钾的质量.
氯化钡和碳酸钾反应生成碳酸钡沉淀和氯化钾,碳酸钡和稀盐酸反应生成氯化钡、水和二氧化碳;
根据生成二氧化碳的质量可以计算碳酸钡的质量,根据沉淀总质量可以计算硫酸钡的质量,进一步可以计算原混合溶液中含硫酸钾和碳酸钾的质量.
解答:解:设碳酸钡的质量为x,
BaCO3+2HCl═BaCl2+H2O+CO2↑,
197 44
x 0.88g
=
,
x=3.94g,
硫酸钡的质量为:8.6g-3.94g=4.66g,
设碳酸钾的质量为y,硫酸钾的质量为z,
BaCl2+K2CO3═BaCO3↓+2KCl,BaCl2+K2SO4═BaSO4↓+2KCl,
138 197 174 233
y 3.94g z 4.66g
=
,
=
,
y=2.76g,z=3.48g,
答:碳酸钾的质量是2.76g,硫酸钾的质量是3.48g.
BaCO3+2HCl═BaCl2+H2O+CO2↑,
197 44
x 0.88g
| 197 |
| x |
| 44 |
| 0.88g |
x=3.94g,
硫酸钡的质量为:8.6g-3.94g=4.66g,
设碳酸钾的质量为y,硫酸钾的质量为z,
BaCl2+K2CO3═BaCO3↓+2KCl,BaCl2+K2SO4═BaSO4↓+2KCl,
138 197 174 233
y 3.94g z 4.66g
| 138 |
| y |
| 197 |
| 3.94g |
| 174 |
| z |
| 233 |
| 4.66g |
y=2.76g,z=3.48g,
答:碳酸钾的质量是2.76g,硫酸钾的质量是3.48g.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
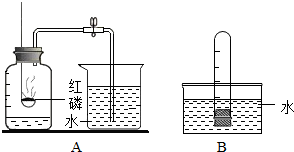
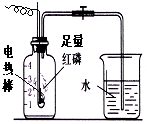 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题: