题目内容
(10广州25)硫酸钠是制造纸浆、燃料稀释剂、医药用品等的重要原料。某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进行提纯的流程如下:

回答下列问题:
(1)用氢氧化钠和碳酸钠除杂时,反应的化学方程式分别为 、
(2)氢氧化钠和碳酸钠如果要添加过量了,可加入适量 溶液除去。
(3)“后续处理”的主要操作时蒸发,为了获得纯净的硫酸钠,应蒸发至 (填序号)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
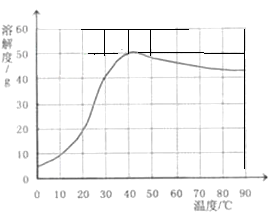
(4)已知硫酸钠的溶解度随温度变化的曲线如右图所示。40℃时,100g蒸馏水中溶解 g硫酸钠达到饱和。将该饱和溶液升高温度至90℃,观察到的现象是 。

回答下列问题:
(1)用氢氧化钠和碳酸钠除杂时,反应的化学方程式分别为 、
(2)氢氧化钠和碳酸钠如果要添加过量了,可加入适量 溶液除去。
(3)“后续处理”的主要操作时蒸发,为了获得纯净的硫酸钠,应蒸发至 (填序号)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
(4)已知硫酸钠的溶解度随温度变化的曲线如右图所示。40℃时,100g蒸馏水中溶解 g硫酸钠达到饱和。将该饱和溶液升高温度至90℃,观察到的现象是 。

(1)2NaOH+MgCl2=Mg(OH)2↓+2NaCl CaCl2+Na2CO3=CaCO3↓+2NaCl
(2)稀硫酸(3)C(4)50,有晶体析出
(2)稀硫酸(3)C(4)50,有晶体析出
分析:(1)本题给出了除去杂质应选用的试剂,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠.
(2)如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳.
(3)在此蒸发过程中,不同于常规的蒸发操作,溶液中含有NaCl,要注意先加热后过滤.
(4)因为40℃时,硫酸钠的溶解度是50克,根据溶解度的定义,100克水中溶解50克硫酸钠恰好饱和.当由40℃升高到90℃时,硫酸钠的溶解度减小,溶解能力下降,所以有硫酸钠固体析出.
解答:解:(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,故填:2NaOH+MgCl2═Mg(OH)2↓+2NaCl,
Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质,所以,除去过量的氢氧化钠和碳酸钠时,可以用稀硫酸,故填:H2SO4;
(3)被加热的滤液中含有一定量的NaCl,故单纯的蒸发操作无法得到纯净的硫酸钠晶体,应该加热使大部分硫酸钠晶体析出,而此时溶液中主要为氯化钠,然后过滤除去滤液,从而的较纯净的硫酸钠晶体,故答案为:C;
(4)根据溶解度的定义以及溶解度受温度影响的关系可知.100克蒸馏水中溶解50克硫酸钠恰好饱和.根据硫酸钠的溶解的曲线可知,在0℃到40℃之间,硫酸钠的溶解度随温度的升高而增大,在40℃到90℃时,硫酸钠的溶解度随温度的升高而减小.饱和的硫酸钠溶液由40℃升高到90℃时,溶解能力下降,所以有硫酸钠固体析出.故填:50,有固体析出.
(2)如果氢氧化钠和碳酸钠过量,可加入适量的稀硫酸,稀硫酸和氢氧化钠反应生成硫酸钠和水,稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳.
(3)在此蒸发过程中,不同于常规的蒸发操作,溶液中含有NaCl,要注意先加热后过滤.
(4)因为40℃时,硫酸钠的溶解度是50克,根据溶解度的定义,100克水中溶解50克硫酸钠恰好饱和.当由40℃升高到90℃时,硫酸钠的溶解度减小,溶解能力下降,所以有硫酸钠固体析出.
解答:解:(1)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,故填:2NaOH+MgCl2═Mg(OH)2↓+2NaCl,
Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)硫酸和氢氧化钠反应生成硫酸钠和水,没有带入新杂质,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳以气体形式逸出,不带入任何其它杂质,所以,除去过量的氢氧化钠和碳酸钠时,可以用稀硫酸,故填:H2SO4;
(3)被加热的滤液中含有一定量的NaCl,故单纯的蒸发操作无法得到纯净的硫酸钠晶体,应该加热使大部分硫酸钠晶体析出,而此时溶液中主要为氯化钠,然后过滤除去滤液,从而的较纯净的硫酸钠晶体,故答案为:C;
(4)根据溶解度的定义以及溶解度受温度影响的关系可知.100克蒸馏水中溶解50克硫酸钠恰好饱和.根据硫酸钠的溶解的曲线可知,在0℃到40℃之间,硫酸钠的溶解度随温度的升高而增大,在40℃到90℃时,硫酸钠的溶解度随温度的升高而减小.饱和的硫酸钠溶液由40℃升高到90℃时,溶解能力下降,所以有硫酸钠固体析出.故填:50,有固体析出.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目